联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
诺奖得主Jennifer Doudna博士在2020年初给《自然》杂志撰写的综述中,系统论述了基因编辑治疗的前景和挑战。在展望CRISPR美好应用前景的同时,这位诺奖得主发出感叹:“递送可能仍然是基因编辑体细胞治疗的***大瓶颈。”
今日,上海交通大学系统生物医学研究院的蔡宇伽团队在《自然-生物医学工程》(Nature Biomedical Engineering)杂志上发表研究论文,描述了他们发明的一种介于病毒载体与非病毒载体之间的类病毒体(virus-like particle, VLP)递送技术,可以递送CRISPR/Cas9 mRNA,实现安全和***的体内基因编辑。研究团队介绍,该技术是中国***完全自主开发的原创型基因治疗载体。

“实现基因编辑酶在体内的瞬时递送是我们基因治疗科学家的梦想。有了这样的载体,我们可以***大限度地提高基因编辑治疗的安全性,也意味着基因编辑体内治疗离临床应用无限接近。然而,实现这个梦想并不容易,也几乎没有人相信可以成功。我从博士生时代开始尝试, 到现在成为博士生的导师,经过10年时间的不断地探索与积累,直到***近才取得了核心突破。”蔡宇伽博士说。
理想的基因编辑递送工具需要兼具瞬时和***的特点,以确保治疗的安全性和有效性。慢病毒载体可以***感染几乎所有的细胞,而非病毒成分mRNA具有瞬时性的特点。蔡宇伽团队利用mRNA茎环结构与噬菌体衣壳蛋白特异识别的原理,通过病毒工程技术,将两者的优点结合起来,创造了新型递送技术VLP-mRNA。
通过VLP-mRNA递送Cas9 mRNA,Cas9的存在时间只有72小时。研究发现,与长时间表达Cas9的病毒系统相比,VLP-mRNA可以显著降低、甚***完全避免脱靶效应。另外,VLP-mRNA可以递送整个CRISPR元件(Cas9与gRNA),克服了腺相关病毒(AAV)载体运载能力小的***,甚***可以递送更大的碱基编辑工具。
研究人员还将VLP-mRNA技术用于眼科疾病的治疗。老年性黄斑变性(AMD)是一种退行性眼底疾病。患者表现为中心视力下降、视物变形、周边部或中心视野出现暗点,对老年人的生活质量造成极大的影响。据统计,西方发达国家中70 岁以上的老年人罹患 AMD 者超过 40%。在中国,随着老年人口日渐增多,黄斑变性的发病率也越来越高。另外,糖尿病患者也可能罹患糖尿病相关黄斑变性,总体发病率在10%左右。
研究团队利用激光诱导的小鼠黄斑变性模型,通过视网膜下腔注射的方式,发现CRISPR特异性地分布在视网膜色素上皮细胞(RPE),而RPE细胞是眼内VEGF的主要来源。VLP递送CRISPR实现了高达44%的vegfa基因敲除,降低了63%的新生血管面积。
第二代测序表明VLP-mRNA未诱导出脱靶效应。对于此前报道的AAV递送CRISPR引起的***段缺失,研究团队通过第三代测序,仅能发现勉强高于背景的信号。值得一提的是,VLP-mRNA无论在体外还是在眼内,均未引起免疫反应。这些实验结果有力支持了CRISPR在黄斑变性基因治疗上的临床应用潜力。
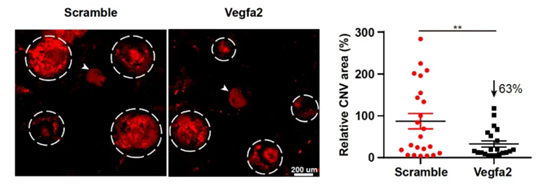
▲VLP递送CRISPR实现了vegfa基因敲除,降低新生血管面积
研究人员总结说,VLP-mRNA可以作为一种通用型的、瞬时性的CRISPR递送工具,兼具***和安全的优点。该技术将帮助CRISPR体内基因编辑治疗时代的真正来临,为无药可治或有药难治的遗传性、获得性以及感染性疾病的患者带来新的希望。