联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
对于自然生命来说,繁育后代是其一生中极其重要的使命。然而,在现代社会,随着生活压力的不断增大以及环境污染的日益加剧,世界各国的不孕不育率都呈现出飙升之势,很多***都饱受不孕不育的困扰。
据统计,我国有超过5000万不育不孕患者,超过正常育龄人口的10%,这一数字超乎我们的想象。
归根结底,繁育子代伊始于精子和卵子的结合,而个体的所有细胞的遗传物质都是相同的,如果能诱导某些细胞***分化为精子或卵子,那么就能在很大程度上缓解不孕不育问题。
人造卵细胞成为可能
2020年12月17日,日本九州大学和RIKEN生物系统动力学研究中心的研究人员在 Nature 杂志发表了题为:Reconstitution of the oocyte transcriptional network with transcription factors 的研究论文。
这项研究表明,一组8种转录因子可以在实验室中将小鼠的多能干细胞转化为卵母细胞样细胞。这一发现进一步加深了我们对卵细胞发育的理解,并可能对生殖医学产生深远影响!

在雌性生殖系发育过程中,原始生殖细胞(PGCs)经历了表观遗传重编程的命运决定和性别决定,***分化成卵母细胞并停留在原始卵泡中。个体进入青春期发育阶段后,原始卵泡被激活,一旦卵母细胞生长被触发,大量的母体RNA和蛋白质就会合成并储存在细胞质中。
由此看来,卵母细胞的生长发生在从原始卵泡到初级卵泡的转变过程中,且伴随着基因表达的动态变化,但遗憾的是,迄今为止,科学家们对控制卵母细胞生长的基因调控网络仍知之甚少。
在这项研究中,林克彦(Katsuhiko Hayashi)等人通过研究小鼠卵母细胞体外发育系统中基因表达的变化并进行相关的功能筛选,由此确定了一组8种足以触发卵母细胞生长的转录因子,每种转录因子都是从原始卵泡向初级卵泡过渡的关键。
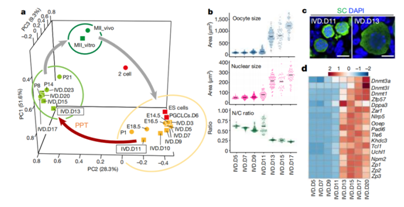
原始到初级卵泡过渡过程所涉基因的功能筛选
这8种转录因子为:
Figla、Sohlh1、Lhx8、Nobox、Stat3、Tbpl2、Dynll1以及Sub1,并且,这些转录因子的编码基因的表达是相互影响的。一个推测的转录网络表明,Lhx8、Sohlh1、Nobox和Tbpl2形成了一个核心网络,而Stat3、Dynll1、Sub1和Figla则是紧密连接。
紧接着,研究团队诱导这8个转录因子在小鼠多能干细胞中表达,以此测试它们是否足以驱动卵母细胞生长。研究人员发现,这些转录因子的强制表达能迅速地将多能干细胞转化为卵母细胞样细胞。
更重要的是,虽然这些卵母细胞样细胞没有进行减数***,但能够受精,并可以***到胚胎发育的8细胞阶段。然而,超过这一阶段的进一步发育还是会会受到影响。
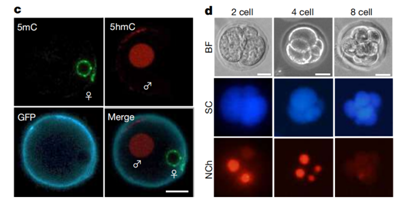
诱导得到卵母细胞样细胞能够受精,且可以***到胚胎发育的8细胞阶段
总而言之,此项研究确定了一组8个用于协调卵母细胞生长的核心转录因子,并提示了一种新的卵质来源——通过诱导多能干细胞分化为卵母细胞样细胞。这或将推动生殖医学的变革,解决人类日益严峻的不孕不育难题!
人造精子
2016年3月,中国科学院动物研究所周琪院士、赵小阳研究员、南京医科大学沙家豪教授合作,在干细胞领域***学术期刊 Cell Stem Cell 杂志发表了题为:Complete Meiosis from Embryonic Stem Cell-Derived Germ Cells In Vitro 的研究论文。
研究团队首先诱导小鼠胚胎干细胞产生了功能性精子样细胞(sperm-like cells),然后将这种精子样细胞注入小鼠卵细胞中,成功产生了能生育的小鼠后代。这也是人类***在实验室中创造出有功能的“人造精子”。

这一研究发现不仅有望解决男性不育症,而且未来还能帮助女性同性恋者,在不需要男性参与的情况下,通过干细胞技术,实现自己做母亲的愿望。
小鼠的孤雌生殖和孤雄生殖
2015年12月,中科院动物研究所胡宝洋研究员、周琪院士、李伟研究员合作,在 Cell Research 杂志发表了题为:Birth of fertile bimaternal offspring following intracytoplasmic injection of parthenogenetic haploid embryonic stem cells 的研究论文。
该研究通过对印记基因的修饰,成功得到了活的具有两个母系基因组的孤雌小鼠,***实现了哺乳动物的孤雌生殖。
不仅如此,2018年10月,中科院动物研究所胡宝洋研究员、周琪院士、李伟研究员再次合作,于干细胞领域***学术期刊 Cell Stem Cell 杂志上发表了题为:Generation of Bimaternal and Bipaternal Mice from Hypomethylated Haploid ESCs with Imprinting Region 的研究论文。
该研究在之前的基础上,结合单倍体干细胞技术和基因编辑技术,***获得具有两个父系基因组的孤雄小鼠,***实现了哺乳动物的孤雄生殖。
结语
步入21世纪以来,人类在发育学领域取得了非凡成就!无论是人造卵母细胞还是人造精子,亦或是哺乳动物的孤雌生殖和孤雄生殖,我们都一一将其变成现实。
由此可见,随着生命科学的飞速发展,曾经不可想象的孤雌生殖、孤雄生殖和人造精卵,如今看来并非遥不可及。或许,在不久的将来,不育不孕***或同性伴侣,就能通过生物技术拥有自己的孩子。