联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
近年来的研究证据表明,并非所有肥胖个体都必然发展出严重的代谢性问题。一部分身体质量指数(BMI)极高的肥胖人群可以在相当长时间内维持机体能量代谢处于正常范围而不引起诸如胰岛素抵抗、糖尿病、高血脂等慢性代谢性病症。故而,体内脂肪增加本身并非决定机体代谢健康的***因素,这类人群也因此被称作“代谢健康型肥胖” (metabolically healthy obesity)。
与此同时,大量的临床研究和动物实验结果指向脂肪组织重塑(adipose tissue remodeling)的模式才是肥胖是否引起代谢性混乱的一个关键决定因素。在肥胖个体中观察到的脂肪组织炎症(inflammation)、纤维化(fibrosis)、缺氧反应(hypoxia)和脂肪细胞肥大(adipocyte hypertrophy)通常指针病理性脂肪组织重塑(pathological remodeling)以及与之相伴生的胰岛素抵抗和高血脂症。于是,设法改善肥胖个体脂肪重塑模式从而治疗或者缓解肥胖引起的代谢性问题成为了一个潜在的治疗策略和方向。
***近几年,人们渐渐将注意力集中到探究脂肪前体细胞(adipocyte precursor cell)及其功能异质性在改善脂肪重塑过程的重要价值【1, 2】。原因在于脂肪前体细胞参与了脂肪组织炎症反应,脂肪纤维化和脂肪细胞分化等多个直接影响病理性脂肪组织重塑的关键生理过程。同时,近些年单细胞RNA测序技术的成熟也为研究脂肪前体细胞这一类具有高度异质性(heterogeneous)、动态性(dynamic)和可塑性(plastic)的细胞提供了技术条件。
2021年2月3日,继近期发表的一系列围绕脂肪前体细胞异质性研究成果【3, 4, 5】,德州大学西南医学中心Touchstone糖尿病研究中心Rana K. Gupta团队在Cell Stem Cell杂志发表题为Pathologic HIF1a signaling drives adipose progenitor dysfunction in obesity 的研究长文,揭示了脂肪前体细胞受HIF1a-PDGF通路调控并影响脂肪组织健康重塑(healthy remodeling)的新机制,同时在动物模型中证实了“抗癌神药”格列卫(Gleevec)通过增强脂肪前体细胞分化能力从而缓解机体代谢紊乱的潜在治疗功能。

https://doi.org/10.1016/j.stem.2020.12.008
在本项研究中,研究人员通过对比小鼠体内具有高度分化能力的内脏脂肪前体细胞和欠缺体内分化能力的皮下脂肪前体细胞的单细胞RNA测序数据,发现了HIF1a分子的活性高低是决定脂肪前体细胞分化能力和引起脂肪纤维化的关键控制机制。高HIF1a分子活性会抑制脂肪前体细胞的分化,导致脂肪细胞肥大;同时,HIF1a激活也促使脂肪前体细胞产生大量细胞外基质分子(如胶原蛋白分子),从而促进脂肪组织纤维化。这两种作用都会加剧脂肪组织病理性重塑,从而引起机体糖脂代谢的失衡,触发代谢性疾病。
进一步的研究发现,HIF1a分子是通过其下游诱导产生和分泌的血小板衍生生长因子(Platelet-derived growth factor, PDGF)控制脂肪细胞功能的。分泌到微环境中的PDGF通过作用于脂肪前体细胞表明的PDGF受体,从而激活胞外信号调节激酶(extracellular signal-regulated kinase, ERK),特异性地磷酸化了脂肪分化关键分子过氧化物酶体增殖物活化受体g(Peroxisome proliferator-activated receptor gamma, PPARg)112号丝氨酸位点,从而抑制PPARg活性以及脂肪前体细胞的分化潜能。
在此发现的基础上,研究人员希望通过药物阻断这一抑制脂肪前体细胞活性的机制从而促进脂肪组织健康重塑,于是选择让肥胖小鼠服用临床上非常成熟的血小板衍生生长因子受体抑制剂“抗癌神药”格列卫(Gleevec)。实验结果表明,格列卫有效地抑制了PDGF引起的PPARg活性抑制,促进了脂肪前体细胞的分化,改善了脂肪组织病理性重塑和机体的代谢平衡。
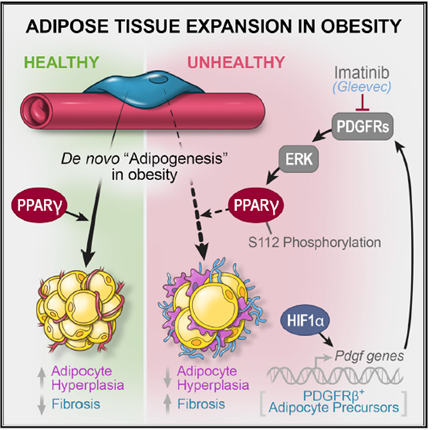
综上,本项研究工作揭示了抑制脂肪前体细胞活性的全新分子机制,从而对于通过基于调节脂肪前体细胞功能从而改善脂肪组织健康以及维护机体代谢平衡提供了新的思考角度;同时在实验动物模型层面,为血小板衍生生长因子受体抑制剂类药物对于代谢性疾病的治疗作用提供了证据支持,从而为进一步研究这类药物在慢性代谢性疾病中的应用提供了线索。