联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
耶鲁大学林晨翔研究组与复旦大学生物医学研究院顾宏周研究组合作在Nature Chemistry期刊上发表了文章 Sorting sub-150-nm liposomes of distinct sizes by DNA-brick-assisted centrifugation,报道了一种全新的脂质体分选策略。研究者利用DNA纳米组装体比重大、均一度好且易编辑的特性,修饰脂质体囊泡使其产生与粒径大小关联的密度差异,从而在密度梯度介质中分离获得尺寸连续分布且均一的脂质体(图1),建立了可用于精确定量研究膜蛋白作用的脂质体平台。
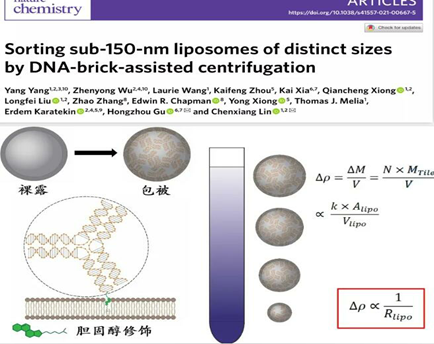
图1:利用DNA纳米组装体辅助脂质体按粒径大小精确分离的原理
作者示范了基于“DNA组装体辅助法”可通过一次超速离心,分离多个粒径连续分布在30-150 nm内且大小高度均一的脂质体组分;与其它常规制备方法相比,新方法不仅实现了多种尺寸脂质体的同时制备,而且将脂质体的大小区分精度从50-100 nm左右提升到10-18 nm,偏差率从35%-40%降低到9%-14%(图2)。
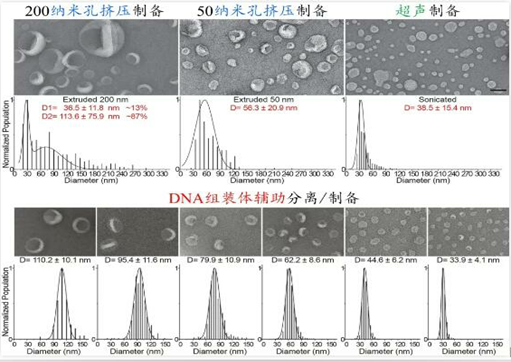
图2:不同方法制备/分离的脂质体囊泡的对比
对于DNA组装体修饰可能会影响脂质体结构的完整度,作者使用脂质体装载一类核酶(感应锌离子发生自剪切的DNA序列)进行了渗漏性的检验:将DNA组装体辅助分选的脂质体置于含有锌离子的溶液中孵育12h,发现脂质体内的核酶没有发生自剪切,直到加入表面活性剂将膜溶解(图3)。这一现象直接证明了分选后的脂质体既不会向内漏入锌离子,也不会向外漏出核酶分子,保持了很好的完整度。同时,作者还发现,经DNA结构包被的脂质体可在室温下保持形态稳定超过六个月,在需要裸露出膜表面时可利用核酸外切酶对DNA组装体修饰进行降解去除。
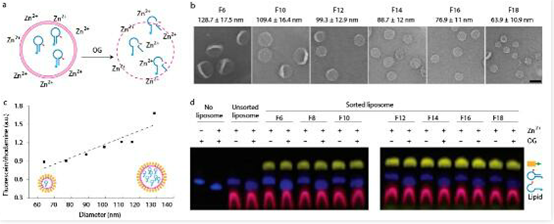
图3:脂质体包载内容物实验及完整度检测
随后,作者基于粒径大小精确可控的一系列脂质体系统性研究了多种膜表面反应和膜蛋白作用。ATG3是一种能够感知膜曲率变化的连接酶,自噬体的生长成熟伴随着其膜表面的磷脂经ATG3催化后的脂质化(GL1)。利用多个粒径分布在30-130 nm的脂质体组分,作者***确定了GL1脂质化反应更易发生在粒径为30-55 nm的脂质体上,且在40 nm时反应效率***高(图4)。由此可见,粒径均一且连续分布的脂质体提高了体外研究脂化反应的精度,为定量分析和测量其它依赖于囊泡粒径大小的生化作用提供了可靠的研究平台。
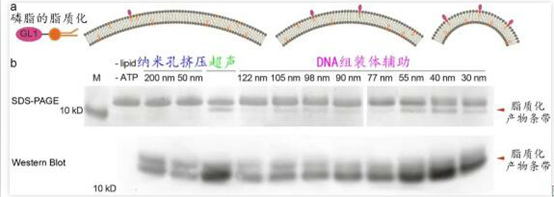
图4:精细化研究曲率敏感的蛋白脂化反应
为调控细胞膜融合的一类关键蛋白,v-SNAREs和t-SNAREs通过特异互作拉近膜之间的相互距离。此前的研究表明,膜曲率可能是决定这一融合过程发生的关键性因素,但因缺乏尺度连续分布的脂质体模型,曲率依赖性膜融合的系统性研究始终无法很好的开展。作者证明DNA纳米组装体同样可辅助Proteoliposome(镶嵌了跨膜蛋白的脂质体)按粒径大小进行精确分离(图5)。在30-110 nm范围内,依托分离出的一系列大小均一并携带了v-SNARE的脂质体,作者得以精确地测量膜曲率对膜融合的影响,揭示了膜曲率越高则融合速率越快,且粒径小于60 nm的脂质体的融合速率和融合轮次显著升高的规律。该工作为更好地模拟细胞生成的囊泡和系统分析测量曲率相关的“膜-膜互作”提供了模板。
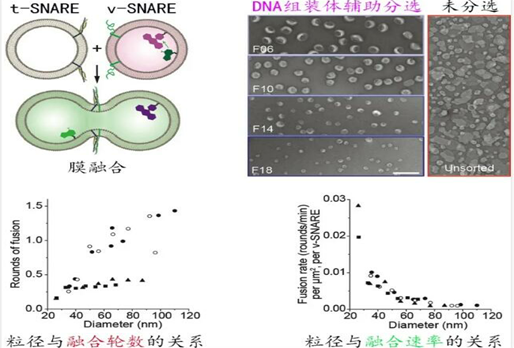
图5:精细化研究曲率与膜融合反应效率之间的关系
值得一提的是,差不多同一时间内,顾宏周研究组于Chem期刊发表 DNA-catalyzed efficient production of single-stranded DNA nanostructures 的文章(详见BioArt今日的单独推送),开发了一套生物合成制备DNA纳米组装体的方法,解决了DNA作为一种消耗品在DNA纳米组装体辅助分选脂质体时的材料来源和成本问题,为大量生产和制备高品质的脂质体扫清了障碍。该脂质体制备方法的成熟有望为膜生物学和脂质体药物递送的研究提供强大的助力。