联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
Nature上的文章“A Lysine–Cysteine Redox Switch with An NOS Bridge Regulates Enzyme Function”。文章通讯作者是来自哥廷根大学的Kai Tittmann教授,他们课题组主要研究方向是酶反应的分子机理。在这篇文章中,他们报道了一种***新发现的控制酶活性的化学开关。

蛋白质半胱氨酸残基之间的二硫键对蛋白质三维结构和稳定性有至关重要的作用,它们可逆性裂解的能力可以使其作为酶中的氧化还原活性催化基团或调控蛋白质功能的变构氧化还原开关。在过去,除二硫键外鲜有被证实的其他共价交联调节开关。在本文中,作者发现了一种介于半胱氨酸-赖氨酸残基之间的共价交联,其通过NOS桥连接两个残基在酶中充当变构氧化还原开关,控制酶的活性。
该化学开关的发现源于作者对淋病奈瑟氏球菌(Neisseria gonorrhoeae)转醛酶(NgTAL)的研究。淋病奈瑟氏球菌是淋病的致病菌,他们原本旨在设计该菌的抑制剂以开发淋病治疗药物。在对其代谢关键酶NgTAL研究的过程中,他们发现其酶活可以通过调节其氧化还原环境发生可逆性激活-抑制。
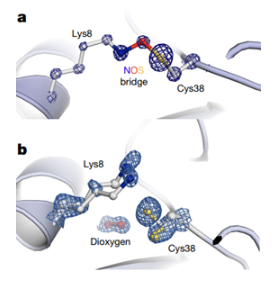
起初作者设想该性质是由于蛋白质内两个半胱氨酸间形成二硫键引起的,但通过对该蛋白序列内3个半胱氨酸残基位点的单独突变,他们发现仅Cys38的突变体能使氧化还原激活无效。加上超速离心法评估氧化和还原环境下该蛋白的聚集状态均为单体,作者假设该蛋白含有除半胱氨酸间二硫键以外的分子内氧化还原开关。
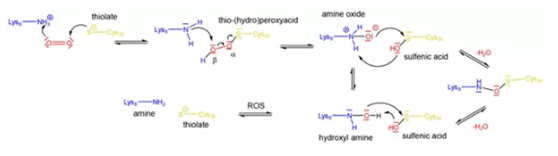
为了进一步研究该氧化还原开关的组成,作者分别在氧化和还原状态下对NgTAL进行结晶,确定了两种状态的结构。在氧化状态下,Cys38与Lys8之间交联且存在一个额外的氧原子,形成带有NOS桥的共价交联键,蛋白中其他两个半胱氨酸残基(Cys87和Cys90)保持硫醇形式;还原态下不存在Cys38和Lys8的交联,两个残基均不含化学修饰,且有多个空间构象可选择。尽管目前没有明确的结构信息确定NOS桥形成的机理,但作者设想了几种不同的反应机制。其中量子化学计算较支持的假设为半胱氨酸或赖氨酸先被氧化,形成次磺酸和羟胺或氧化胺。羟胺和氧化胺都是有效的亲核试剂,可以与氧化的半胱氨酸反应,随后,NOS桥的形成与脱水过程同时发生。
为了理解NOS键后NgTAL活性降低的结构基础,作者叠加了氧化和还原的结构,值得注意的是,氧化还原开关的Cys38位于延伸的链状结构上,该结构从蛋白质表面到达活性位点,并连接活性位点残基Ser42和Asn43。这揭示了一种酶活调节的“加载弹簧”机制(loaded-spring mechanism),该机制涉及氧化还原激活时的结构弛豫,弛豫从蛋白质表面的变构氧化还原开关传播到蛋白质内部的活性位点。这种弛豫导致关键催化残基的重新配置,并引起酶活发生数量级的增加。
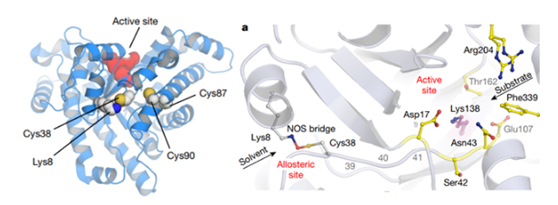
***后,作者为了探究该氧化还原开关是否存在于其他蛋白,作者通过遗传分析证明了形成NOS桥的Cys-Lys残基在同菌属和其他进化分枝中的TALs蛋白中高度保守,并在PDB中搜索发现了其他诸多可能含有NOS桥结构的蛋白质。这说明该氧化还原开关并非NgTAL独有的特征。
总得来说,作者报道了一种通过NOS桥连接的赖氨酸-半胱氨酸氧化还原开关,可以控制酶的活性。该发现有望被推广到蛋白质设计和小分子抑制剂开发等领域。
生物磁珠对细胞筛选的方法已日渐成熟,原理是将包被一抗的磁珠与细胞表面对应的分子特异性结合,或者将包被二抗的磁珠与已经与细胞表面分子特异性结合的一抗结合。磁珠携带与之结合的细胞吸附与分离柱或试管上,实现阳性细胞或阴性细胞的分离。洛阳吉恩特生物自主研发生产了各类生物磁珠,可以实现稳定的实验结果。