联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
研究帕金森病发病机制的科学家们发现,一种被称为LRRK2的蛋白酶发生突变,是导致家族性和偶发性帕金森病的关键原因之一。这种蛋白因此也成为近年来开发帕金森病疗法的一个潜在药物靶点。
日前,***学术期刊《细胞》在线刊登了一篇研究论文,圣裘德儿童研究医院(St. Jude Children’s Research Hospital)结构生物学家孙吉博士领衔的团队,***破解了人类LRRK2全长蛋白的高分辨率结构,为LRRK2的生理和病理作用提供了机制上的见解。这项成果对开发新疗法治疗帕金森病提供了结构上的洞见,开辟了一条特异性靶向异常LRRK2蛋白的研究途径。

蛋白酶LRRK2参与多种细胞生理过程,作为一种激酶,它的作用就像一个生物酶促反应的开关。编码LRRK2的基因发生的多种突变,会产生过度激活形式的激酶,以至于在脑细胞中形成病理性的LRRK2蛋白纤维丝,导致细胞功能障碍和死亡,从而破坏帕金森病患者的神经元功能。
鉴于LRRK2的重要性,先前的一些研究已经了解LRRK2蛋白的部分结构域。然而,LRRK2蛋白由7个结构域构成,组成复杂,了解完整的结构才能揭示这种酶如何被调节,对于设计针对帕金森病的药物至关重要。在这项研究中,孙吉博士与同事们利用冷冻电镜(cryo-EM)技术,***破解了完整的LRRK2蛋白分子的高分辨率结构。
“人体内有大约600种激酶,而且所有激酶看起来都非常相似,如果我们只设计靶向激酶结构域的药物,很难实现特异性。”孙博士说道, “但如果我们能理解这种蛋白质如何被调节,能靶向这种调节作用,就可以在设计药物时实现特异性。完整的蛋白结构为设计LRRK2 抑制剂提供了一个新的方向。”
全长 LRRK2 的高分辨率结构使研究人员得以确定该分子中的一些“疾病热点”,已知会致病的多种突变发生在这些区域。识别这些热点,有助于理解致病突变为何会异常激活LRRK2。
其中一种***常见的LRRK2突变形式称为G2019S,已知会导致帕金森病。研究人员通过解析这一致病突变体的结构,可以进一步设计药物使这一突变体失活,为治疗帕金森病提供机会。
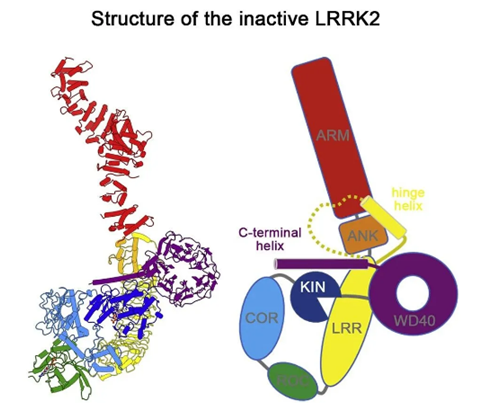
▲失活状态的全长LRRK2结构
更重要的是,研究人员不仅确定了单个LRRK2分子(即“单体”)的结构,还确定了两个连接的LRRK2分子(即“二聚体”)的结构,为进一步研究LRRK2的功能提供了基础。
“真实的生理条件下,LRRK2只有在二聚体形式时才有活性,”孙博士解释说,“对于LRRK2如何在细胞中起作用的谜题,此次获得的二聚体结构将成为解谜的起点。”
利用这一结构,研究人员还提出了一种全新的帕金森病治疗方法。研究人员发现,如果对二聚体中两部分的连接点进行基因改造,可以让LRRK2无法产生病理性纤维丝。
“如果我们设计出的药物同样能够防止这些纤维丝的病理形成,那也许是治疗帕金森病的另一种途径。”孙博士说。
生物磁珠对细胞筛选的方法已日渐成熟,原理是将包被一抗的磁珠与细胞表面对应的分子特异性结合,或者将包被二抗的磁珠与已经与细胞表面分子特异性结合的一抗结合。磁珠携带与之结合的细胞吸附与分离柱或试管上,实现阳性细胞或阴性细胞的分离。洛阳吉恩特生物自主研发生产了各类生物磁珠,可以实现稳定的实验结果。