联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
在之前的研究中,科学家已经发现,高脂饮食(HFD)可能驱动了结直肠癌的生长。近日,高脂饮食引起结直肠癌的证据再添一笔。美国麻省理工学院(Massachusetts Institute of Technology)的Miyeko Mana教授领导的研究团队详细阐述了高脂饮食引发结直肠癌背后的分子机制,为结直肠癌的预防和治疗提供了新的思路。本研究发表在Cell Reports杂志上。

要看懂这个研究,就先要了解肠道的生理特性。在我们进食后,肠道会分泌消化液来消化食物。但这些消化液会不断侵蚀肠壁,造成损伤。幸好肠道里有一批干细胞(ISC),能够不断分化出新细胞,填补肠壁上的损伤。
然而ISC却和结直肠癌的发病有关。先前研究表明,在ISC中存在一种高脂肪感受器分子(high-fat sensor molecules),它们能够感知高脂水平。等到ISC适应高脂饮食时,就会进一步增殖,提高肿瘤的发生风险。
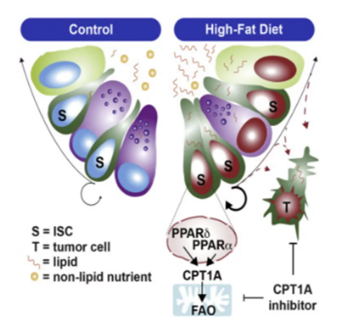
▲ISC内高脂饮食诱发的致癌机制
其中一种受体感受器就是过氧化物酶体增殖物激活受体(PPARs)。PPARs属于Ⅱ型核激素受体超级家族,能调控基因表达,对细胞癌变有关键作用。
体外实验发现,PPARα和PPARδ参与了ISC的高脂饮食反应,在小鼠模型中,研究团队分别给予小鼠长期高脂饮食或正常饮食,试图探索PPARα和PPARδ对肿瘤风险的作用。
在之前的研究中,PPARδ信号通路已被证明在结肠癌发生、发展过程起重要作用。于是,研究团队先敲除了小鼠的Ppard基因,然而他们仍然观察到ISC对高脂饮食的适应。因此研究人员猜测PPARα、PPARδ之间存在功能冗余,并通过一系列实验确定了这种可能性。
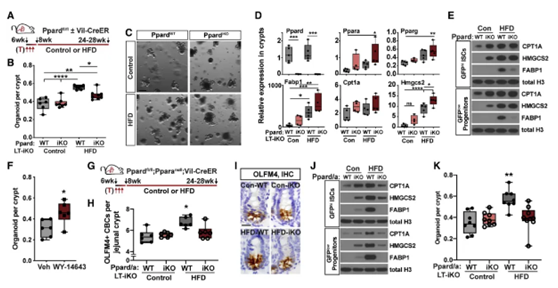
▲PPARδ与PPARα功能冗余作用增强了高脂饮食ISC的活性
接下来,研究人员找到了这两种PPARs的共同下游靶点,那就是线粒体蛋白Cpt1a。Cpt1a是细胞脂肪酸氧化代谢过程中运输长链脂肪酸至线粒体所必需的一种蛋白,而高脂饮食中恰恰含有丰富的长链脂肪酸(LCFAs)。
为了进一步探索Cpt1a蛋白对高脂饮食的作用,研究团队进行了小鼠的Cpt1a基因敲除实验。他们发现,Cpt1a的缺失阻止了ISC的扩增和增殖,从而阻止肠道肿瘤的形成,降低癌症发生风险。
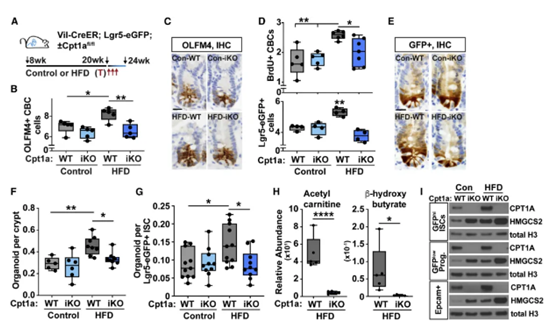
▲Cpt1a介导的脂肪酸氧化促进了高脂饮食ISC的干细胞特性
综合这些发现,研究人员门指出高脂食物中的脂肪被分解为游离脂肪酸(free fatty acids)。然后,游离脂肪酸会刺激诸如PPARs的传感器,启动下游基因,将脂肪酸转运到线粒体进行氧化代谢,制造能量来供养ICS继续繁殖、生长与再生,从而大大增加了基因突变的可能性,诱发了结直肠癌的发生。通过这个研究,高脂饮食导致肿瘤形成的整个过程也终于在研究人员眼前徐徐铺开。
这个研究告诉我们,除了让人发胖外,高脂肪还有促进结直肠癌发病的风险。为了我们的健康,还是让我们先学会管住嘴,减少高脂肪的摄入吧!
ctDNA的提取在肿瘤筛查中,是重要的前置步骤。目前常用的提取方法是利用生物磁珠,主要是硅羟基磁珠或羧基磁珠对血清血浆的ctDNA进行提取,由于磁珠的粒径小,比表面积大,在特定提取缓冲液中,对核酸的吸附会更加灵敏,相比于其他方法,使用生物磁珠对进行ctDNA提取得率会更高,检测灵敏度和检出限也会更合适,搭配核酸提取仪,更能实现全程自动化的提取。