联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
《自然》杂志在线发表了颜宁教授团队的一篇***新论文,揭示了强效止痛药齐考诺肽(ziconotide)与人类N型电压门控钙离子通道Cav2.2相结合时的结构。这一发现有助于更深地理解该药物的作用机理,并给未来的止痛药开发带来了洞见。

▲颜宁教授为本研究通讯作者,高帅与姚霞博士为本文共同一作
Cav2.2通道存在于人类的***和外周神经系统中,是参与疼痛信号传导的关键成员。在自然界中,不少毒素能够对这一通道进行强效的抑制,齐考诺肽就是其中之一。这种来源于海蜗牛的毒素已得到美国FDA的批准,用于缓解严重的疼痛。然而这种具有止痛能力的毒素也会引起不良反应,从而***了它的应用。
为了更好地理解齐考诺肽的作用机理,它与Cav2.2通道结合时的结构就成了破局的关键。在这项研究中,科学家们使用冷冻电镜技术,获得了Cav2.2通道与齐考诺肽结合前后的结构,用于比对分析。
先前人们早已发现齐考诺肽能选择性地抑制Cav2.2,本研究中获得的结构则进一步确认了这一点——齐考诺肽能通过Cav2.2上一些带电荷的极性残基,稳稳“卡”在钙离子的入口处。它并没有完全封堵钙离子的进出通道,而是通过中和通道外部的电负性(electronegativity),为钙离子进入通道设置结构上的障碍。
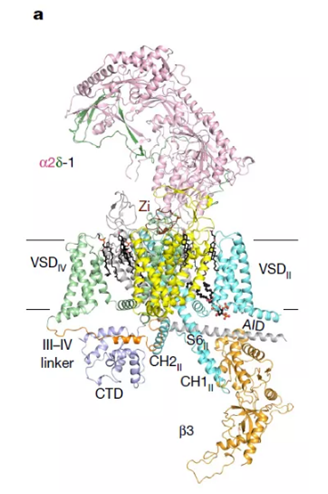
▲Cav2.2的结构是我们理解其功能的基础
进一步研究发现促进齐考诺肽结合的8个残基中,有4个在其它电压门控钙离子通道中并不保守存在。这也能解释为何齐考诺肽对Cav2.2具有高度特异性。
此外,研究人员们还发现Cav2.2的α2δ-1亚基与胞外环状结构(ECL)在与齐考诺肽结合时,会共同朝上发生倾斜,为其让路。
以上发现均聚焦于Cav2.2的胞外结构。而在Cav2.2的其它结构上,研究人员们也发现了一些不寻常之处。比如其跨膜片段S6II显得特别长,在细胞质一侧形成了一段长螺旋。在S6II长螺旋之后,又是两个额外的螺旋结构,将结构伸回细胞膜的方向。在Cav1和Cav3通道中,都未曾观察到类似的结构。因此研究人员们推测,这一专属于Cav2.2的结构可能与其某种功能有关,如促进关闭整个通道。
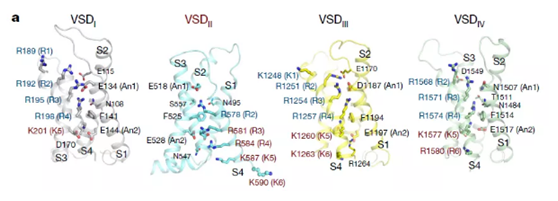
▲VSD II的构象与其它三个VSD都不同
本论文的作者们也发现与之前的Cav1.1和Cav3.1通道类似,Cav2.2的四个电压感知结构域(VSD)具有不同数目的带电残基。然而与其它两个通道不同的是,Cav2.2中的VSD呈现了不同的构象——VSD I、VSD III与VSD IV都呈现“升起”的构象,而VSD II则发生了结构域的旋转和结构域内的重排,表现出“下降”的构象。这一结果引起了研究人员们的额外注意,因为在不引入突变的情况下,还从未观察到VSD呈现“下降”构象。
后续分析发现这一构象的形成离不开几个极性残基与VSD II的跨膜片段S6II之间的结合。此外一种叫做PIP2的分子与VSD II结合后,也能进一步稳定它的构象。至于这一构象存在的意义,还有待于未来的更多探索。
总结来看,本研究提供了人类Cav2.2与齐考诺肽结合前后的高清冷冻电镜结构,揭示了齐考诺肽抑制Cav2.2的机理,并展现了属于Cav2.2的数个独特结构。结合过去对其它Cav家族成员的研究,这些发现有望带来关于此类“止痛通道”的更多洞见,为将来开发创新药物铺平道路。
DNA提取磁珠可以有效的从标本中提取基因组DNA、病毒DNA或游离DNA,采用化学合成的方法将四氧化三铁进行特殊的处理,使其粒径达到均一化分散,再通过特殊的材料进行官能基团(如硅羟基、羧基)的包覆。包覆官能基团后,磁珠具备了核酸吸附能力,配合核酸提取仪,可以自动化的提取DNA和RNA。