联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
肾脏是维持血浆中葡萄糖水平的重要器官。当葡萄糖跟随血液流经肾脏时,绝大部分葡萄糖都会被滤出、重吸收回血液。而在肾脏中负责葡萄糖重吸收的主要蛋白,就是钠-葡萄糖共转运蛋白(SGLT)。
在人类中,SGLT已知包含了SGLT1到SGLT6这6种亚型,在肾脏中主要起作用的为SGLT1和SGLT2。其中,SGLT2负责原尿中90%葡萄糖的重吸收,其活性依赖于附属亚基MAP17;而SGLT1负责残余葡萄糖的重吸收。
重吸收过程使得我们摄入的葡萄糖等营养物质能得到更***的利用,但对于糖尿病患者来说,这个过程却并不美妙。如果能抑制SGLT蛋白的功能,使原尿中的葡萄糖无法被重吸收,从而通过尿液排出体外,那么就能帮助他们实现降血糖的目的。因此,仅在肾脏中负责重吸收绝大部分葡萄糖的SGLT2,成为治疗糖尿病的重要小分子药物靶点之一。
1886年,德国药学家约瑟夫•冯梅林教授发现从苹果树根皮中萃取的天然产物根皮苷(Phlorizin)可以使动物多尿、排出尿糖、减轻体重。随后的研究发现,根皮苷就是SGLT的天然抑制剂。
基于根皮苷的结构,已有包括恩格列净(Empagliflozin)在内的多种SGLT2特异性抑制剂被开发出来,并应用于2型糖尿病的临床治疗。这些SGLT2抑制剂验证了“通过尿出糖来降血糖” 这一治疗思路的正确性,并且还展现出治疗心衰、肾脏保护等多种临床效果。
但是,这类备受关注的药物究竟是如何抑制SGLT2蛋白功能的,却始终没有得到解答。一个重要原因在于,SGLT2蛋白的精细结构尚未得到解析。
现在,北京大学未来技术学院分子医学研究所陈雷课题组解决了上述问题。在一项发表于《自然》杂志的***新研究中,他们通过冷冻电镜对SGLT2-MAP17复合物和抑制剂的结构进行解析,阐明了SGLT2抑制剂的工作机制。

陈雷教授表示,解析SGLT2蛋白的结构***挑战性,因为SGLT2和MAP17复合物的分子量很小,结构稳定区只有80 kDa(千道尔顿)左右;该结构不具有对称性;此外,二者均没有稳定的可溶区结构域。
面对这一挑战,研究团队创新性地采用“三接头固定”策略,将绿色荧光蛋白(GFP)融合在SGLT2胞内的环区,并将与GFP结合的纳米抗体融合在MAP17胞内端。这样,利用GFP和纳米抗体的高亲和力,就能将两者的复合物嵌合在SGLT2-MAP17胞内侧,为冷冻电镜观测提供了标记。
借助这一策略,研究团队***终获得了分辨率为2.95 Å的SGLT2-MAP17复合物与其抑制剂恩格列净结合的冷冻电镜结构。
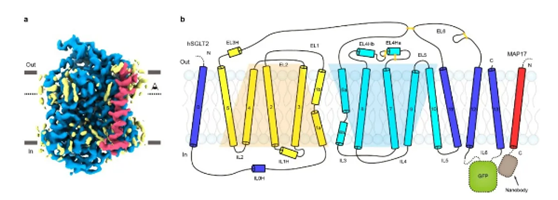
▲SGLT2-MAP17蛋白的电子密度图和拓扑示意图
冷冻电镜成像显示,SGLT2为14次跨膜蛋白,含有从TM0到TM13这14个跨膜螺旋。其中,TM1-TM10为转运的核心结构,该结构与原核生物亮氨酸转运蛋白(LeuT)类似。而TM0、TM11-TM13在核心结构的周围,附属亚基MAP17通过疏水相互作用与TM13结合。
此外,这项研究还揭示了抑制剂恩格列净与SGLT2蛋白结合的机制。恩格列净结合在SGLT2蛋白的中间,抑制剂的葡萄糖基占据了葡萄糖的结合位点,葡萄糖基的羟基与SGLT2的氨基酸发生了极性相互作用。抑制剂的糖苷配基从葡萄糖结合位点往外延伸,直到蛋白外侧,将SGLT2锁定在向外开放状态。
如下图所示,抑制剂的不同基团与SGLT2的不同氨基酸相互作用,牢固地结合在一起。而将与抑制剂结合的SGLT2氨基酸突变为SGLT1对应的氨基酸时,抑制剂的抑制效果也减弱。这在一定程度上解释了恩格列净对SGLT2相较于SGLT1的高选择性。
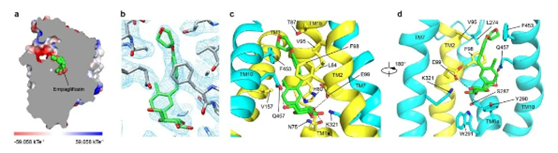
▲抑制剂恩格列净的结合位点
因此,研究团队通过对冷冻电镜成像结果的解析,发现抑制剂将SGLT2锁定在向外开放状态,确定了SGLT2抑制剂的结合位点,并且阐述了SGLT2剂抑制的工作机制。陈雷教授表示,这项研究为SGLT家族抑制剂的进一步优化提供了结构基础,并且为基于该结构的药物设计提供了模板。
RNA提取磁珠属于纳米生物磁珠的一种,主要作用是用于核酸提取过程中的RNA提取,粒径分布在500nm左右,是洛阳吉恩特生物自主研发生产的高分子纳米磁性微球,该磁珠悬浮时间长,磁响应时间迅速,对DNA甲基化过程中的提取环节提供良好的支持,可明显缩短实验时间,提高实验效率,并在提取结果上保持稳定,配合核酸提取仪,更能实现快速的RNA提取。