联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
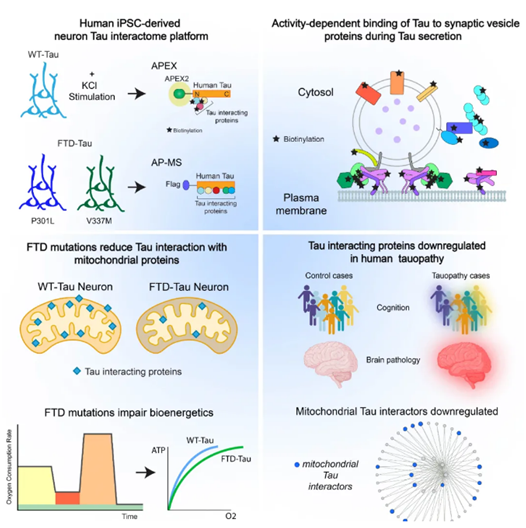
正常的tau蛋白能与细胞骨架的组成成分微管结合,帮助维持细胞结构的稳定。但当tau蛋白错误折叠,它们会聚集形成神经原纤维缠结,而这些缠结是阿尔茨海默病的标志性特征之一。此前的研究已经揭示,编码tau蛋白的基因的突变,可以导致额颞叶痴呆等神经退行性症状。然而,tau蛋白在这些疾病中的确切作用机制依然是个谜。
随着对tau蛋白研究的深入,科学家发现它们比此前想象的更加复杂。美国巴克研究所的助理教授,***新研究的***作者Tara Tracy介绍道:“我们注意到,tau蛋白可以由神经元分泌,并向周围的细胞传递。不过人们并不清楚的是,这个过程是如何发生的、又有哪些细胞机制参与了这个过程。”
在一项发表于《细胞》的***新研究中,来自康奈尔大学威尔康奈尔医学院、巴克研究所、加州大学旧金山分校等机构的研究团队绘制出tau蛋白互作组图谱,并且揭示了tau蛋白分别与突触、线粒体相关的作用机制。

“tau蛋白是神经退行性疾病研究的焦点,理解它如何产生毒性、导致认知衰退,将有希望为这些疾病带来新的疗法。”这项研究的***,威尔康奈尔医学院的Helen and Robert Appel阿尔茨海默病研究所主任甘莉教授表示。
在正常和病变的神经元中,tau蛋白均可以与具有多种功能的特定蛋白质相互作用。为了揭示异常tau蛋白参与的相互作用有哪些不同之处,研究团队首先利用诱导性多功能干细胞培养出人类神经元——其中部分神经元携带了正常的编码tau蛋白的基因,另一些神经元相应基因的突变则会导致额颞叶痴呆。
随后,研究团队利用两项先进的蛋白质组技术,建立了tau蛋白互作组图谱。这份图谱描绘了在实验室培养的神经元中,所有tau蛋白与其他蛋白质的相互作用。
其中,亲和纯化质谱(AP-MS)可以用于研究稳态条件下的蛋白质相互作用,从而比较正常与携带致病突变的tau蛋白的行为。此外,为了了解在动态条件下,神经元活动如何影响tau蛋白互作组,作者使用工程化抗坏血酸过氧化物酶(APEX)技术,标记与tau蛋白邻近的蛋白质。
▲人类神经元中tau蛋白互作组的作用方式
“这两个高度定量化的蛋白质组技术,让我们能以***的时间和空间分辨率,建立人类神经元中tau蛋白互作组的图谱。” 甘莉教授评价道。
在这项研究中,这份全新的图谱已经帮助研究团队取得了新的发现——作者揭示了tau蛋白参与两个重要过程的机制。
之前的研究已经发现,神经元分泌的tau蛋白可以传递给周围的神经元,因此致病的异常tau蛋白也会传遍大脑的其他区域。***新研究揭示了这个过程的机制。当神经元活动增强时,它们分泌的tau蛋白与突触小泡外表面的蛋白质相互作用。这些突触小泡存储的神经递质在神经元连接时释放。对于tau蛋白,这个释放过程可能与位于突触前末梢的SNARE复合体有关。因此,这个tau蛋白释放的可能机制,能为阻止tau蛋白离开神经元的后续研究提供思路。
从tau蛋白互作组图谱中,研究团队还发现了tau蛋白与神经元中产生能量的线粒体相互作用。“越快越多的研究将能量代谢失调与神经退行性疾病联系在一起,但具体的机制尚不清晰,”甘莉教授表示,“我们发现,致病突变抑制了tau-线粒体蛋白质的相互作用,从而对线粒体的功能造成损伤。”一个直接影响便是,身体中***耗费能量的过程——大脑中的能量生产——受到了影响。而供能不足的大脑可能面临损伤。
随后,研究团队通过对患者数据的分析,发现阿尔茨海默病患者的tau相互作用蛋白含量更低,包括线粒体蛋白质。其中,对于症状***为严重的患者,这些蛋白质的含量也***低。这表明研究团队在神经元中的发现,也与人类患者相关。
接下来,研究团队计划探究,提高线粒体-tau蛋白的相互作用,能否提升能量代谢从而抵消致病突变的影响。此外,他们还将研究哪些细胞过程将允许具有毒性的tau蛋白通过突触传遍整个大脑,并寻找阻止这一过程的方式。
对于这项研究的更多意义,甘莉教授认为,其团队的研究可能帮助科学家开发全新的生物标记物,用于检测线粒体功能失调的早期迹象,从而让医生可以在疾病进程的初期进行干预。
生物磁珠对细胞筛选的方法已日渐成熟,原理是将包被一抗的磁珠与细胞表面对应的分子特异性结合,或者将包被二抗的磁珠与已经与细胞表面分子特异性结合的一抗结合。磁珠携带与之结合的细胞吸附与分离柱或试管上,实现阳性细胞或阴性细胞的分离。洛阳吉恩特生物自主研发生产了各类生物磁珠,可以实现稳定的实验结果。