联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
从真菌到动植物,不同真核生物进行氧化磷酸化的结构基础都高度相似。不过,当科学家以更高的分辨率研究很少受到关注的囊泡虫类时,却找到了其中的特例。一项发表于《科学》杂志的发现,嗜热四膜虫(Tetrahymena thermophila)的呼吸方式与其他以后鞭毛类为代表的真核生物存在差异,这也反映了真核生物核心代谢的多样性。

嗜热四膜虫是一种属于纤毛纲的自由生活单细胞真核生物,广泛分布于全球的淡水环境,通过摆动全身数百根纤毛来游动。虽然数量多、分布广,但它们却很少受到科学家的关注。正是在这些不起眼的生物身上,藏着生命能量代谢演化的秘密。
简单来说,真核生物的有氧呼吸通过三步反应,利用有机物和氧气为生命活动提供化学能。其中,氧气参与的氧化磷酸化是这个反应的***后阶段:在线粒体内膜上,前两个步骤产生的还原性代谢产物(如NADH和琥珀酸)的电子通过电子传递链传递给氧气分子,所形成的跨膜质子梯度则被ATP合成酶转化为ATP。电子传递链由4个膜蛋白质复合体(I-IV)组成,分别是NADH-辅酶Q氧化还原酶(复合物I,简称CI)、琥珀酸脱氢酶(CII)、辅酶Q-细胞色素c氧化还原酶二聚体(CIII2)和细胞色素c氧化酶(CIV),它们在氧化磷酸化过程中起到至关重要的作用。
科学家早已注意到,四膜虫的电子传递链与其他真核生物有所差异。上世纪五十年代,有研究发现其细胞匀浆可以还原,但是不能氧化商品化的细胞色素c,并推测其电子传递链不具备细胞色素c氧化酶/复合体IV,代之以某种与动植物不同的特殊末端氧化酶。但长期以来,没有人知道高度保守的复合体IV为什么会在四膜虫线粒体中消失。
在这项研究中,来自浙江大学医学院的周龙研究员团队与来自加州大学戴维斯分校的James Letts助理教授团队合作,利用高分辨率冷冻电镜探究了嗜热四膜虫的电子传递链。
论文***作者周龙研究员介绍道,这项研究在冷冻电镜技术上采用了前沿的“结构蛋白质组”思路,即利用部分纯化的混合蛋白样品收集一套单颗粒数据,并从中同时解析出多个结构。同时,本研究***发现了大量未被报道的电子传递链新亚基,在没有具体序列信息的情况下,完全依靠电子密度和有限注释的蛋白质组信息从头搭建了结构模型,实际上以结构研究代替传统的分子与生化手段,对这些亚基进行了补充注释。一位匿名评审专家在审稿意见中写道“报道了令人印象深刻的大量新结构信息,并展现了冷冻电镜技术的能力所在”。
本研究解析了嗜热四膜虫超复合体I-III2(Supercomplex I+III2, SC I+III2)及复合体IV二聚体(CIV2)2.6Å与3.0Å的冷冻电镜结构。这些(超)复合体的整体结构展现出了相当的特殊性。其中,SC I+III2由91个亚基组成,分子量约为2.3 MDa;相比之下,哺乳类SC I+III2只有1.4 MDa,67个亚基。另一方面,CIV2的分子量更是达到了2.7 MDa,每个单体包含52个亚基;作为对比,哺乳类、植物和真菌的单体CIV只有10~14个亚基。
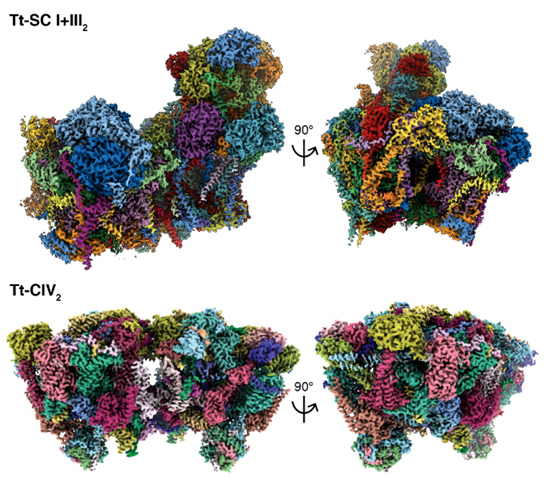
▲嗜热四膜虫超复合体I-III2及复合体IV二聚体的冷冻电镜结构
上述复合体的结构揭示了四膜虫电子传递链在亚基组成,结构形式和功能机制上与其他真核生物存在的较大差异。例如,以后鞭毛类(酵母与动物)为代表的真核生物复合体I应该包含14个核心亚基和31~37个附属亚基。然而,四膜虫复合体I却打破了这个规律:其负责辅酶Q结合与质子转运的3个膜内核心亚基ND1、ND2与ND5发生了***,因此核心亚基数量增加到17个。同时,四膜虫复合体I的附属亚基也达到了51个,其中20个为***发现的;其他31个附属亚基则在真核生物中存在不同程度的保守性,提示它们在真核生物的***后共同祖先中已经存在了。
在高度保守的超复合体SC I+III2层面上,CI和CIII2的相对位置与其他真核生物的类似,说明SC I+III2在***后共同祖先中也已经出现,或者不同真核生物演化支出现了趋同进化。
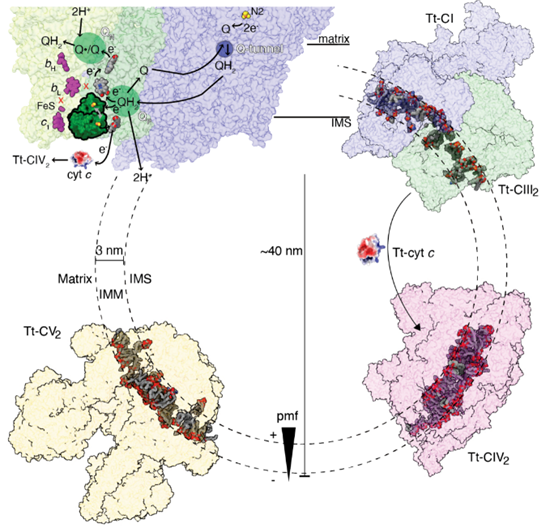
▲嗜热四膜虫的电子传递链
值得注意的是,四膜虫CIV2除分子量巨大外,其细胞色素c结合位点特化为一个能将整个细胞色素c包埋的深坑,且内部的表面电荷与哺乳类相比出现了正负反转。早期研究因物种间无法进行电子传递而假设四膜虫不具备复合体IV,这项研究解除了这个误会。四膜虫CIV2与后鞭毛类相比呈现出高度的特异性,其附属亚基中出现了三个结合在外周的线粒体转运蛋白SLC25A家族成员,其中一个基本确定为-酮戊二酸转运蛋白。另外,四膜虫CIV2每个单体上还结合着一个来自线粒体内外膜转运系统的-螺旋桨结构,推测与其装配过程或线粒体氧化还原稳态调控相关。
这些电子传递链复合体的独特结构说明,真核生物核心代谢过程有着超乎想象的多样性。这项研究从一个经典模式生物入手,在结构、功能、调控等多个层面密集地打破了电子传递链复合体的现有范式,拓展了对该领域多样化可能性的理解,为其研究注入了新的活力。此外,这项研究能够从未经纯化的样本中同时获取整个代谢通路的结构,这种创新性的研究策略也将助力未来的研究。