联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
一项发表于Cell Stem Cell期刊的研究中,由约翰•霍普金斯大学医学院领导的研究团队在体外培养出能自我更新的人类肌肉干细胞,并利用这类细胞在小鼠体内成功修复受损的肌肉组织。这一突破为治疗人类的肌肉损伤及肌肉减少症指出了潜在的方向。

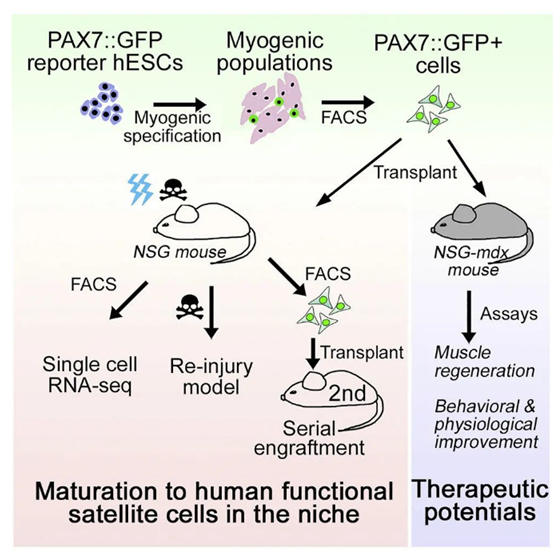
为了制备这种自我更新的干细胞,研究团队以实验室培养的人类皮肤细胞为起点,通过基因编辑将这些细胞转变为更原始的诱导多能干细胞(iPS细胞),它们具有演变为体内任意细胞的潜力。
事实上,科学家早已能够在实验室中将iPS细胞转变为皮肤细胞、脑细胞等多种不同的细胞。但更加困难的问题在于,如何让iPS细胞变为能自我更新的特定器官的干细胞。
为了实现这一目标,在***新研究中,作者使用富含营养物质及标准细胞生长因子与的培养基,将iPS细胞诱导为肌肉干细胞。
随后,研究团队在小鼠实验中,检验了这种新培养出的细胞在活体动物中如何迁移,以及能否修复受损组织。
当他们将新培养的肌肉干细胞注射至小鼠的肌肉中,这些干细胞会移动到肌肉的干细胞龛(niche)中,这里正是小鼠自身的肌肉干细胞聚集的区域。这些干细胞在这一区域停留了至少4个月。
这些干细胞能否起到修复受损组织的作用?作者使用了两种不同的手段来验证这一问题。
首先,作者将肌肉干细胞注射进基因编辑小鼠体内,这些小鼠缺少正常的免疫系统,因此可以避免移植的细胞造成免疫排斥。随后,这些小鼠被暴露在造成肌肉降解的毒素和辐射中,从而清除体内已有的肌肉干细胞。
研究者发现,在肌肉组织的毒素和辐射损伤部位,移植的肌肉干细胞发育成为成肌细胞,它们融合并发育成正常肌肉中的微纤维,从而成功修复肌肉损伤。他们还发现,一些移植的肌肉干细胞迁移到干细胞龛之后,与小鼠自身的肌肉干细胞行为相似。
▲***新研究的实验设计示意图
而在第二项验证实验中,研究者将肌肉干细胞移植至另一种基因编辑小鼠体内。这些小鼠调控肌营养不良蛋白的基因发生了突变,因此会患上杜氏肌营养不良症。
研究团队发现,移植的肌肉干细胞迁移到肌肉的干细胞龛区域。在为期数月的实验中,接受了移植的小鼠在滚轮测试中,跑动速度是未接受移植的小鼠的两倍,反映了更强的肌肉强度。
“这些肌肉干细胞有望为多种肌肉疾病提供新的疗法。” 领导这项研究的Gabsang Lee教授指出。
接下来,研究团队计划进一步探索,如何在有其他肌肉相关症状的小鼠模型中让这一策略发挥作用。我们期待,未来这项技术或许能应用于运动损伤、外伤和与衰老相关的肌肉损失的治疗,为人类患者带来全新疗法。
DNA提取磁珠可以有效的从标本中提取基因组DNA、病毒DNA或游离DNA,采用化学合成的方法将四氧化三铁进行特殊的处理,使其粒径达到均一化分散,再通过特殊的材料进行官能基团(如硅羟基、羧基)的包覆。包覆官能基团后,磁珠具备了核酸吸附能力,配合核酸提取仪,可以自动化的提取DNA和RNA。