联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
《自然》杂志在线发表了一篇北京大学研究团队的***新论文。毛有东教授领衔的科研团队,使用国际前沿的创新技术,大幅提升冷冻电镜的时间分辨率分析精度,揭示了人源蛋白酶体(proteasome)的动力学调控机制。
研究团队指出,作为影响细胞内蛋白质降解的生命分子机器,蛋白酶体是治疗一系列重大疾病的药物靶点,因此对其动力学调控和构象变化实现精准观察,有望推动新一轮药物研发的重大创新。

在真核细胞(包括人类细胞)内,泛素-蛋白酶体系是定向降解蛋白质的一种主要方式。2004年,诺贝尔化学奖授予三位科学家,表彰他们对该泛素化蛋白质降解机制的历史性发现。在这一过程中,待降解的蛋白质作为底物被打上“泛素”标记,进而被蛋白酶体识别;然后,蛋白酶体如同一台蛋白质粉碎机,将底物切割成碎片,实现精准降解。蛋白酶体功能紊乱,与癌症、神经退行性疾病、免疫疾病等一系列人类疾病有关。
围绕蛋白酶体,毛有东教授实验室在先前的一系列工作中,基于冷冻电镜技术逐步揭示了其原子架构、组装原理和降解泛素化底物的动力学基本规律。蛋白酶体全酶又称为26S proteasome,由中间一个圆柱形20S核心颗粒和两端覆盖的一个或两个19S调节颗粒组成。19S包含一个环形异源六聚体马达——AAA-ATPase,通过多个协同ATP水解模式调控蛋白酶体降解泛素化底物。
在正常细胞中,蛋白酶体的功能受到多个水平的严格调控。去泛素化酶USP14就是蛋白酶体的一个主要调控分子,它通过与蛋白酶体发生可逆的结合,切除底物上的泛素链。
然而,这一过程速度极快,蛋白酶体降解底物的时间尺度在毫秒到秒之间,因此要看清USP14如何被蛋白酶体激活并调控蛋白酶体功能,始终是个***的难题。
而这正是此次研究的突破所在:在原子水平上呈现了蛋白质降解过程中USP14和蛋白酶体的构象连续体。
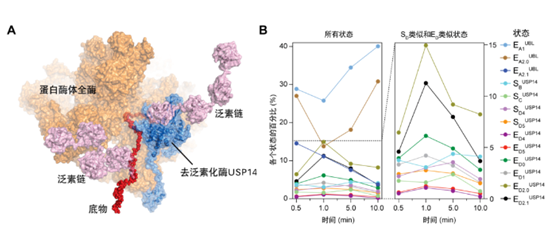
▲ USP14调控下蛋白酶体复合体降解多泛素化底物的原子结构模型之一 (A), 时间分辨率冷冻电镜解析13种中间态的统计分布随蛋白质降解进程的时间演化(B)
为了用冷冻电镜技术捕获该过程的中间态结构,研究团队首先设法放慢了这个过程。通过大量的条件摸索,重建反应动力学体系和优化反应条件,研究人员获得了45000多张含时USP14-降解泛素底物过程中的冷冻电镜透射图样,挑取了超过300万个USP14-26S-泛素底物复合体的颗粒图像。
接下来,更关键的一步是对如此大量的图像进行分类,呈现出蛋白反应的动态过程。为此,研究组借助人工智能,利用经过数年自主开发的新型深度学习高精度三维分类和四维重建方法,捕获了USP14-26S复合体降解多泛素化底物过程的13种不同功能中间状态的高分辨率(3.0~3.6埃)非平衡构象,重建出受控蛋白酶体的完整动力学工作周期。
“这是国际上***将人工智能四维重建技术用于大幅提升时间分辨冷冻电镜分析精度。”研究团队强调。
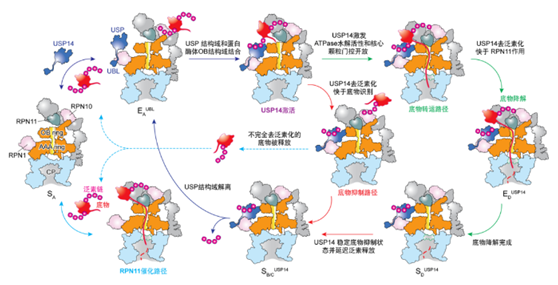
▲通过时间分辨冷冻电镜分析获取的USP14调控蛋白酶体底物降解的并行路径模型
结合分子生物学功能和基因突变研究,这项研究工作***终阐明了USP14和26S蛋白酶体相互调控活性的原子结构基础和非平衡动力学机制。
研究发现,USP14的活化同时依赖于泛素识别和蛋白酶体RPT1亚基的结合。出人意料的是,USP14通过别构效应,诱导蛋白酶体同时沿着两条并行状态转变路径发生构象变化。该研究成功捕获到了底物降解中间状态向底物抑制中间状态的瞬时转化,为USP14调节26S蛋白酶体的完整功能周期提供了全新的高分辨见解。
《自然》同期发表的评论文章中,审稿人对该研究有着很高的评价,指出“该工作是一项重大研究,终于在原子水平解决了USP14活化和其调控蛋白酶体功能的机制问题”。
“这项突破对于发现靶向药物有多重意义。”毛有东教授指出,“过去我们基于结构的药物设计是静态的‘死结构’,现在我们可以针对靶蛋白实际执行功能的动态过程中的高分辨构象有的放矢地设计药物分子,‘打’的是有实际功能的构象;其二,精准定义靶蛋白的动态过程,我们就可以更好地预测药物分子作用机制和动力学,有更多可以选择打靶的中间态构象,从而极大扩展了药物分子的可设计空间,提高分子设计的成功概率。此外,相比分子动力学计算模拟的方法,我们的技术看的是真实的动力学,也对于靶蛋白分子量没有上限。更重要的是,我们看的是‘功能动力学’,是真实的药物分子要去结合的靶构象,这个在可见的将来还难以用分子动力学计算模拟来实现。”
生物磁珠对细胞筛选的方法已日渐成熟,原理是将包被一抗的磁珠与细胞表面对应的分子特异性结合,或者将包被二抗的磁珠与已经与细胞表面分子特异性结合的一抗结合。磁珠携带与之结合的细胞吸附与分离柱或试管上,实现阳性细胞或阴性细胞的分离。洛阳吉恩特生物自主研发生产了各类生物磁珠,可以实现稳定的实验结果。