联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
近30年来,基因疗法的出现开启了现代医学的全新时代,为多种遗传疾病的患者带来了彻底治愈的希望。而在围绕着基因疗法的挑战中,其中一项便是如何将基因编辑工具递送至人体内的目标区域。
不难想象,执行这项任务的载体必须要具备这些基本特性:作为基因要搭乘的“便车”,这个载体能将自身的遗传物质导入宿主细胞;同时,这个载体必须足够安全,没有自我复制能力,也不会致人患病。另外,这个载体需要具有靶向性,能***地找到目标细胞。
腺相关病毒(AAV)正是满足这些条件的理想载体。作为一种存在复制缺陷的病毒,除非有其他腺病毒的辅助,否则AAV无法自我复制。根据目前的研究,AAV不会致人患病,基因整合进宿主细胞基因组的风险也很低。在AAV的基础上,科学家改造制备的重组腺相关病毒(rAAV)进一步避免了基因整合的风险,因此成为基因疗法的有效载体。
不过,从理论到实际的规模化生产又是另一道难题。当今,rAAV载体的***规模化生产就面临这样的悖论:直接由载体携带DNA进入目标细胞时,这个名为转染的过程虽然安全,但效率不足;相反,如果有腺病毒辅助参与这个过程,生产效率是提高了,但由于辅助腺病毒能够在宿主细胞中自我复制,可能造成安全隐患。
如何利用辅助腺病毒的***,同时消除安全隐患,成了长期困扰研究人员的一道难题。近期,在一项发表于《自然•通讯》的研究中,来自药明生基全资英国子公司OXGENE与牛津大学的研究团队开发了一款能够大规模、安全生产无转染rAAV的系统——TESSA™。与传统的质粒转染途径相比,无需转染的TESSA™技术能将rAAV的产能提升20倍,并确保生产过程安全无污染,产物的质量也远超传统手段。

论文作者之一,药明生基和OXGENE***科学官Ryan Cawood博士介绍道:“以合理的成本大批量生产纯化的AAV载体,是细胞与基因疗法的产业面临的一项巨大挑战。我们聚焦于辅助腺病毒生产,这种策略易于实现规模化,并且易于操作。”
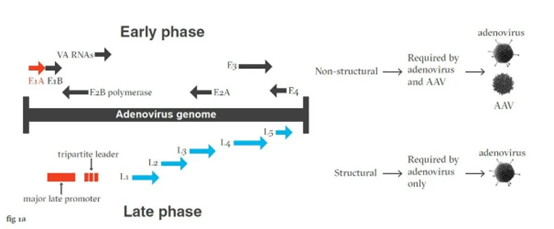
要规避腺病毒导致污染的风险,让我们从理解腺病毒的生命特性开始。腺病毒的生命周期包括早期与晚期两个阶段:早期阶段提供了rAAV生产所需的辅助功能,而晚期阶段负责生产腺病毒结构蛋白,使得腺病毒能够自我复制。
所以思路很清晰:腺病毒的早期阶段是生产rAAV时希望利用的特性;而晚期阶段却是需要规避的。因此,如果只允许腺病毒经历生命周期的早期阶段、人为终止晚期的结构蛋白合成,那么腺病毒就能辅助rAAV的生产,同时避免造成污染。
▲腺病毒生命周期示意图(图片来源:OXGENE)
要实现这一点,关键就在于如何操纵腺病毒自我复制的开关——主要晚期启动子(major late promoter,MLP)。
可以说,有了MLP调控晚期基因的转录,才有腺病毒结构蛋白的合成。因此,研究团队要做的就是设计基因开关,在受控的条件下终止腺病毒晚期的生命活动。
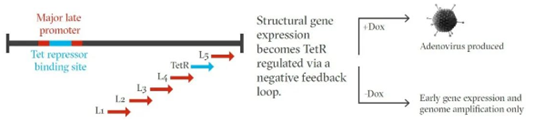
为此,研究团队基于一种已经被证明有效的基因开关——四环素遏制蛋白(TetR),设计了全新的策略。这类蛋白广泛分布于细菌与古菌中,正常情况下它会与基因组中一个负责基因表达的操纵子结合。这个操纵子(全名四环素抗性操纵子,简称TetO)被遏制蛋白占用后,就无法继续转录下游的基因了。
不过有一种例外情况,一旦有四环素类似物(如强力霉素)存在,那么遏制蛋白就会转而与四环素类似物结合,这时操纵子也空了出来,可以正常调控基因表达。
▲通过插入TetO,让腺病毒无法产生结构蛋白(图片来源:OXGENE)
理解了这个原理后,让我们回到腺病毒的问题上。研究团队向MLP中插入了一个操纵子,这时,当不存在四环素类似物时,遏制蛋白与操纵子结合,MLP受到抑制。结果就是,腺病毒只能进行基因组的复制,却无法生产新的结构蛋白。
由此,一个调控腺病毒结构相关基因表达的反馈循环出现了,这就是四环素激活自沉默腺病毒(Tetracycline-Enabled Self-Silencing Adenovirus,也就是上文中TESSA的全称)系统。
TESSA™技术实际生产rAAV的效果究竟如何?研究团队进行了***度的检验。他们测试了TESSA™生产不同rAAV血清型的产能、安全性与质量,尤其是rAAV2血清型——相比于其他天然的AAV血清型,现有途径生产rAAV2的产能明显更低,这也成为困扰业界的一大难题。
为了检验TESSA™技术生产rAAV2血清型的产能与质量,研究团队使用经过改造的TESSA™技术,在人源细胞系中生产rAAV2,并与目前常用的传统无辅助质粒系统进行了对比。传统途径在72小时时rAAV2产能***高,接近2×104 GC/cell(即每个细胞的基因组拷贝数);相比之下,TESSA™在96小时内的产能持续增加,超过了3×105 GC/cell。综合而言,TESSA™将rAAV载体的产能平均提升了20倍之多。
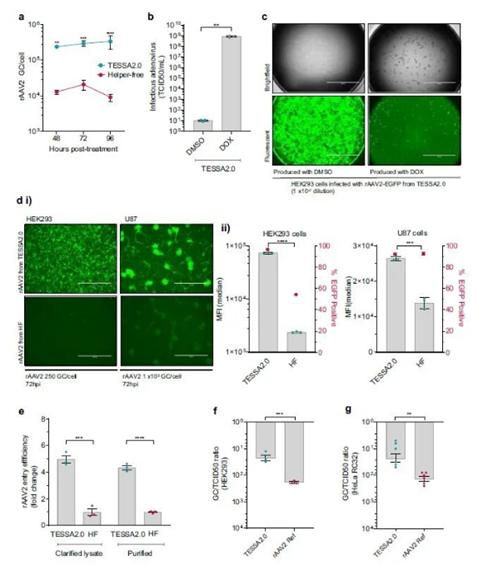
▲在人源HEK293细胞系中,TESSA™生产rAAV2的产能显著高于质粒转染途径
除了产能的提升,基于TESSA™生产的rAAV2质量(即转导能力)也是基于质粒转染生产的5倍。TESSA™技术的安全性同样得到了确认:四环素类似物缺失时,具有感染性的腺病毒几乎消失,避免了可能的污染。
除了rAAV2,研究还验证了TESSA在更多血清型中的优异表现:在rAAV6/8/9中,TESSA™将rAAV的产能提升了10~25倍,将产物的转导能力提升了7~60倍,实现了rAAV***、安全的大规模生产。
总体而言,相比于无辅助的传统质粒系统,TESSA™技术生产的病毒滴度可提高1个数量级,不同血清型的转染滴度(含基因组的病毒载体的转染能力)提升了数十甚至数百倍,反映rAAV质量的实心率也提升了13倍左右。rAAV生产效率的提升也将大幅提升基因疗法的效率:以脊髓型肌萎缩症、血友病A和血友病B为例,TESSA的产量可供应的病患人数是传统质粒系统的15倍左右。
这些实验结果共同表明,TESSA™能够实现安全、高质量、低成本的大规模产业化rAAV生产,使其有可能颠覆AAV生产工艺、成为行业未来。