联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
德国马克斯•普朗克免疫生物学和表观遗传学研究所Erika L. Pearce教授领衔的研究团队对这一疑问进行了科学的解答,该团队在《PNAS》杂志发表了一篇题为Fever supports CD8+ effector T cell responses by promoting mitochondrial translation的重要成果,发现机体体温的升高有益于优化CD8+T细胞的代谢活性和功能,增强线粒体蛋白的翻译效率,从而有效抵御癌细胞的侵袭。

https://doi.org/10.1073/pnas.2023752118
发烧是人体炎症感染的常见症状,当人体免疫系统受到病毒病原体刺激后,会导致白细胞分泌介质细胞因子,并在酶的催化下合成前列腺素,前列腺素进入下丘脑后,体温调控中心便会将人体的体温设置点提高以对付病毒。随着近年来研究的深入,医学界推断这种发烧现象可能与分泌大量细胞因子和细胞毒性分子的T细胞的早期激活相关。
为了在体外模拟人体的发热过程,研究人员分别在37°C和39°C的环境下利用抗CD3/CD28激活纯化的CD8 + T细胞,经24小时的培养发现, 高温激活的CD8+T细胞能分泌更多的细胞因子,同时,由于发热时机体新陈代谢加快,糖代谢加强,肝糖原和肌糖原分解增多,因此葡萄糖代谢相关分子的表达量也增加。
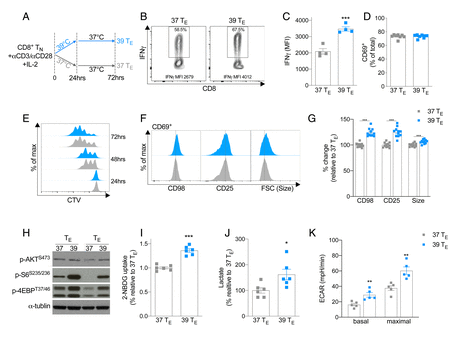
暴露于 39 °C 会促进 CD8 + T E细胞功能和合成代谢
此外,高温激活的CD8+T细胞会产生从静止的幼稚 T 细胞到完全激活的效应 T细胞表征的转变,产生能控制病原体或肿瘤生长的细胞因子和细胞毒性分子。不仅如此,在T细胞的进化过程中,糖代谢会出现一种“重编程”现象,且随着人们对肿瘤生物学及肿瘤代谢复杂性的了解深入,发现该现象正是恶性肿瘤的一个重要标志。
随后,研究人员将这些激活的T细胞过继到髓系白血病小鼠体内,惊喜的发现小鼠体内的抗肿瘤反应增强,且注射39℃刺激后的T细胞的白血病小鼠生存率显著提高,这进一步说明发热有益地提升宿主免疫力。
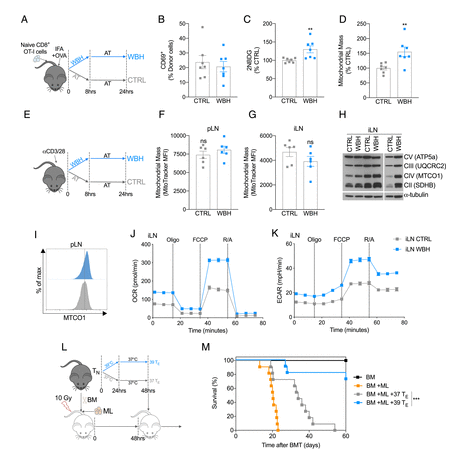
暴露于 39 °C 可改善体内 T 细胞代谢和功能
众所周知,线粒体能调节细胞内的能量水平及氧化还原状态,并经多条信号传导途径影响肿瘤细胞命运,且线粒体翻译延伸因子4(mtEF4)是线粒体蛋白翻译过程的“开关”,在肿瘤的发生发展过程中扮演重要角色。
因此,研究人员将线粒体翻译抑制剂(Antibiotic tigecycline, TIG)处理后的39℃ T细胞重新过继转移至髓系白血病小鼠模型中,发现接受TIG处理后的39℃ T细胞的小鼠抗肿瘤能力减弱,说明线粒体翻译因子是39℃ T细胞在调控抗肿瘤进程中或不可缺的。
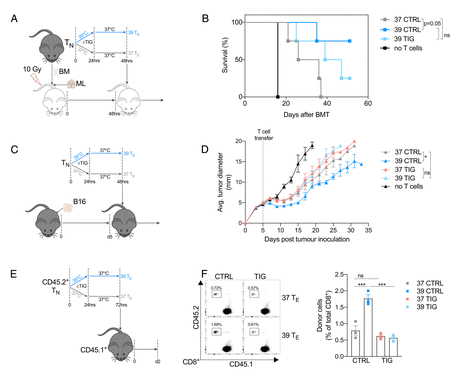
当线粒体翻译受损时,CD8 + T E细胞暴露于发热温度的保护性抗肿瘤作用就会消失
总而言之,该研究揭示了发烧有益于CD8+T细胞的代谢过程、增强自身的抗肿瘤能力,简单来说,就像是一台计算机不断的升级过程。未来,或许能将该研究成果应用于临床中,为肿瘤患者带来希望。
DNA提取磁珠可以有效的从标本中提取基因组DNA、病毒DNA或游离DNA,采用化学合成的方法将四氧化三铁进行特殊的处理,使其粒径达到均一化分散,再通过特殊的材料进行官能基团(如硅羟基、羧基)的包覆。包覆官能基团后,磁珠具备了核酸吸附能力,配合核酸提取仪,可以自动化的提取DNA和RNA。