联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
数百种细菌居住在我们的消化系统中,影响着神经发育、癌症免疫疗法应答等方方面面。同时,粪便移植也在癌症、代谢疾病、衰老等病症的治疗中展现出巨大潜力。
不过,在目前的肠道微生物组研究中,存在一个亟待解决的问题:对于极为复杂的微生物组,科学家无法系统研究其中不同成分的功能。举例来说,目前的粪便移植研究会直接引入个体完整的微生物组,科学家可以知道这个微生物组与癌症的治疗有关,但在这几百种细菌里,究竟是哪些细胞、分子在起作用就无从知晓了。

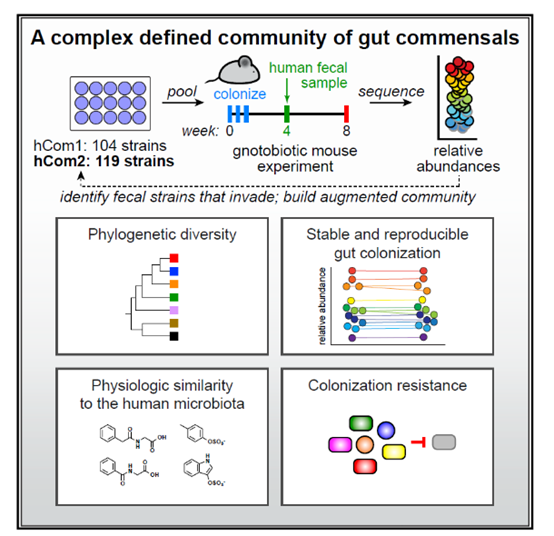
在一项发表于《细胞》的研究中,来自斯坦福大学的研究团队打破了这样的局面。他们的破局方式是人工培养、合成微生物组,并且构建了迄今***复杂、完备的合成微生物组。该群落由119个细菌物种组成,移植至小鼠体内后,能执行正常的肠道微生物组功能。
由于科学家可以根据研究的需要任意添加、移除或是编辑特定的细菌种类,合成微生物组可以让科学家更清晰地理解微生物组与健康的关联,***终开发出全新的微生物组疗法。
这项研究由Michael Fischbach教授领导,他们从零开始培养单一的细菌物种,并将它们混合,构建出合成微生物组。
虽然听起来像是在调配鸡尾酒,但这项工作远没有那么容易。由于不同细菌在肠道中占据着各自的生态位、参与特定的反应,因此研究团队需要确保***终的混合物稳定、平衡,不会因为某种细菌而影响到其他细菌的功能。
为此,研究团队决定从***常见的微生物出发,他们将希望寄托于人类微生物组计划(Human Microbiome Project , HMP),这个由NIH主导的项目对超过300位成年人的完整微生物基因组进行了测序。
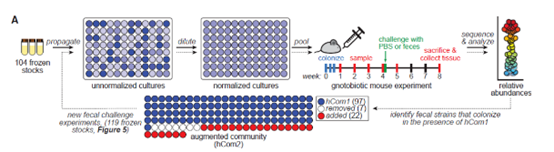
研究团队从中寻找人们普遍拥有的细菌。***终,他们选中了超过100种菌株,它们出现在至少20%的HMP参与者的肠道内。经过一些调整,***终确定了104种细菌,分别培养、***终混合形成hCom1(human community one的简称)微生物组。
▲这项研究构建了复杂、完备的合成微生物组
这个合成微生物组能否在真实肠道环境中立足?作者利用小鼠进行了检验。他们将hCom1引入一批小鼠体内,这些小鼠已经事先经过改造,体内不含任何细菌。结果,hCom1中98%的细菌物种在小鼠肠道中立足,并且相对含量在两个月后仍能维持不变,展现出良好的稳定性。
不过,相比于天然的微生物组,这个合成微生物组可能仍然缺失某些功能。于是,研究团队利用天然的人类微生物组,对hCom1进行了迭代完善。
通过粪便移植,他们将完整的人类微生物组引入上述拥有合成微生物组的小鼠体内。在小鼠的肠道中,已经共存了数十年的人类微生物组,与仅仅共存几周的合成微生物组相遇。这时,合成微生物组是会被天然微生物组摧毁,还是仍然能保持主导地位呢?
试验结果是后者。***终的微生物群落中,只有10%的细胞来自人类微生物组。
有理论认为:任何细菌在加入现存的群落后,只有能够填补此前未被占据的生态位,才能存活下来。因此,这10%新立足的细菌,或许就能填补合成微生物组缺失的功能。
由此,研究团队将这些新立足的细菌与合成微生物组混合,迭代出由119种细菌组成的新群落,命名为hCom2。相比于hCom1,其功能更加完备。
▲实验流程示意图
接下来,研究团队验证了hCom2的保护作用。他们用大肠杆菌感染微生物组为hCom2的小鼠,结果和拥有天然微生物组的小鼠一样,它们也能够抵御感染。
基于这个模型,研究团队可以通过删除、修饰特定的细菌,来明确究竟是哪些细菌起到防御作用。作者表示,目前他们已经初步锁定了几种细菌,并计划开展进一步的研究。