联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
当人体的免疫系统逐步走向崩溃时,也就到了艾滋病患者的发病期,这时,人体除了遭受HIV病毒的大肆攻击,还要面对其他趁虚而入的病毒细菌,患者的生命也通常在这一时期走到终点。
更糟糕的是,在科学家分离出HIV病毒的近四十年里,仍然没有一款有效的艾滋病疫苗诞生。这是因为HIV属于逆转录RNA病毒,本身就有很高的基因突变率,其次,在宿主细胞内进行复制时首先需要把RNA逆转录成DNA,而逆转录过程出错率很高,这使得HIV病毒的外壳(膜蛋白)也很容易发生变异,甚至同一个患者身上早期和晚期的病毒都有所不同,因疫苗产生的抗体也就随之失效了。再者,HIV病毒外层的特异性刺突膜蛋白的糖基化程度很高,这就相当于给HIV的抗原又套上了一层“糖盾”,能够逃脱人体免疫细胞的识别和攻击。此外,HIV病毒可以潜伏在细胞内,并通过细胞之间的接触“足不出户”就完成感染,这使得抗体根本没有用武之地。缺少合适的动物模型也是疫苗难以研发的原因之一。
为此,科学家希望能够找到一款疫苗,能在人体内诱导bnAbs的生成。目前这一领域主要存在三种诱导bnAbs的策略,包括:(1)B细胞谱系疫苗设计,即从天然HIV感染者体内分离出bnAbs,然后使用计算衍生的克隆谱系作为模板设计HIV疫苗免疫原;(2)种系靶向疫苗设计,首先刺激bnAbs前体B细胞,然后用一系列合理设计的增强免疫原,引导B细胞从原始的幼稚B细胞(或种系)状态成熟,从而诱导bnAbs生成;(3)以表位为中心的疫苗设计,即利用基因工程手段,在体外合成HIV病毒的表位(epitope,能够决定抗原特异性的化学基团,又称抗原决定簇),直接作为疫苗使用。
不论哪种策略,诱导bnAbs的关键都在于如何用疫苗刺激那些稀有的能够生成bnAbs的B细胞前体,即能否从未成熟的幼稚B细胞中挑选出一批***有潜力的“精锐力量”完成进一步发育。这一步类似于一个“启动”阶段,难点在于,这批“精锐部队”只占B细胞总数的百万分之一!
在发表于Science的一篇文章“Vaccination induces HIV broadly neutralizing antibody precursors in humans”中,研究人员验证了种系靶向疫苗设计策略的安全性和可行性,结果显示,在接种了两剂疫苗的36人中,有35人(97%)产生了抗体,且未发生严重的副作用。
图1 研究成果
研究人员共招募了48名健康的参与者,其中18名参与者接受注射了两剂低剂量的疫苗,18名接受两针高剂量疫苗,其余12名接受两剂安慰剂,两次接种的时间间隔为8周。该疫苗旨在激活HIV VRC01类bnAbs的B细胞前体,VRC01是目前研究得比较多的一种HIV病毒广谱中和抗体。
研究人员在参与者接种疫苗/安慰剂的前后20周时间内,选择不同时间点多次采集了参与者外周血单核细胞中的记忆B细胞和浆母细胞,以及通过淋巴结穿刺获得的GC(germinal centers,生发中心)B细胞。通过表位特异性B细胞分选、B细胞受体测序以及生物信息学统计分析,研究人员发现:
■ 在接受疫苗的36人中,97%的人在研究结束时产生了VRC01类bnAbs;
■ 接受高剂量疫苗的参与者与接受低剂量疫苗的参与者相比,抗体水平略高;
■ 所有48名参与者中,98%的人出现了轻微的副作用,多数在1-2天内消失,与其他疫苗一致。
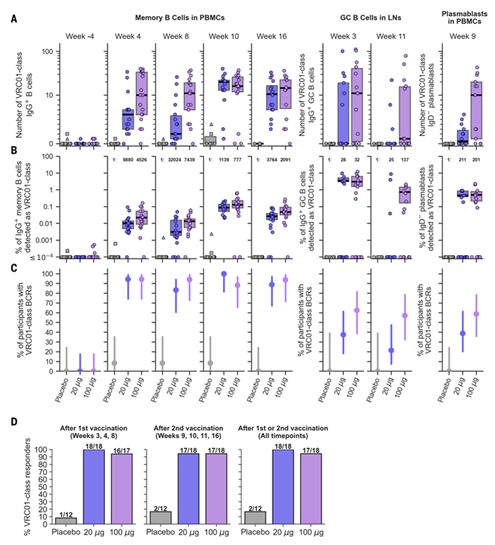
图2 血液和淋巴结中VRC01类IgG B细胞的存在情况
德克萨斯大学微生物学和免疫学系副教授Gary Kobinger评价以上结果表示:“这篇论文描述了我见过的***好的 HIV 疫苗接种 B 细胞免疫反应。”不过,根据产生的抗体水平,Kobinger预测,可能需要两剂以上的注射才能预防感染。
Kobinger还对这种疫苗设计策略抱有极大的期望,认为该方法也能够运用到开发其他快速变异病毒的疫苗中去:“如果它能成功,那将会成为疫苗学家武器库中对抗高突变率病毒的一种新工具。”
DNA提取是分析农作物分子生物学性状的重要步骤,现阶段,常用的DNA提取技术有磁珠法和离心柱法,使用磁珠进行农作物的DNA提取,可以实现高通量、自动化的操作。由于磁珠对核酸的吸附灵敏度高,只需要少量的叶片或其他组织即可得到高得率、高纯度的DNA。吉恩特生物采用自主研发生产的纳米生物磁珠和磁珠法DNA提取试剂盒,可以从各种类型的农作物中提取高质量的核酸,配合核酸提取仪,可以达到快速自动化提取的目的。