联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
***近几年,CRISPR基因编辑系统在癌症治疗领域被广泛探索, 它可以精准编辑患者特定基因,并与腺病毒载体(AAV)结合,快速有效地激活免疫系统,以对癌细胞发起攻击。 然而,由于个体间存在差异,导致现有疗法很难在大部分患者群体中取得良好的效果。
通常情况下,每个人的免疫细胞T细胞表面都有特异性受体(TCR),可以特异性识别癌细胞突变。为此,科学家们假设,如果能将患者T细胞受体分离出来,在经基因编辑后再重新输入到免疫细胞中,或许可以产生个性化且有效的细胞疗法。
发表在 《Nature》 上一篇***新研究中,来自加州大学洛杉矶分校等多机构的研究团队***开发了一种基于CRISPR/Cas9的非病毒精准基因组编辑的临床级疗法,可以有效重定向免疫细胞以识别自身癌细胞中的突变。在***人体临床试验中,该疗法取得良好的效果。该研究证明了非病毒精确基因组工程用于制造临床级基因工程过继细胞转移疗法的可行性和安全性。

在这项新研究中,该团队开发了一种一种基于CRISPR/Cas9非病毒精确基因组编辑的临床级方法。该方法同时敲除两个内源性TCR基因TCRα(TRAC)和TCRβ(TRBC),并在TRAC位点插入新抗原特异性TCR(neoTCR)的两条链。然后,利用了一系列技术来有效定义T细胞对超过60个人类白细胞抗原(HLA)I类等位基因突变的新抗原反应。
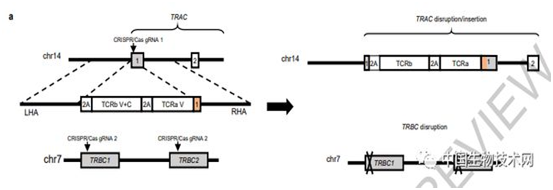
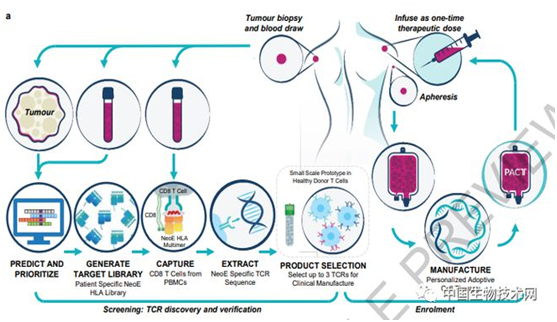
在***人体1期临床试验中,他们治疗了16名患有各种难治性实体瘤患者,包括结肠癌、乳腺癌和肺癌。从患者血液中分离出T细胞受体(TCR)与个性化可溶性预测新抗原-HLA捕获试剂结合显示,患者自身癌症有多达350个突变,超过5000个突变靶向34种HLA亚型。
然后,研究人员对免疫细胞特异性识别癌症突变的TCR基因进行测序,发现共有175个新分离的neoTCR。***后,他们通过一步式CRISPR编辑,敲除现有的TCR,并将经基因编辑的neoTCR敲入患者自身的免疫细胞中,以重新引导免疫细胞特异性识别癌症中的突变。
DNA提取磁珠可以有效的从标本中提取基因组DNA、病毒DNA或游离DNA,采用化学合成的方法将四氧化三铁进行特殊的处理,使其粒径达到均一化分散,再通过特殊的材料进行官能基团(如硅羟基、羧基)的包覆。包覆官能基团后,磁珠具备了核酸吸附能力,配合核酸提取仪,可以自动化的提取DNA和RNA。