联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
在该项研究中,通过操控下丘脑兴奋性神经元,***实现了灵长类动物的温度调控,并通过功能性核磁共振成像技术描绘了温度调节时大脑的神经网络连接,这一低温模型或许是通向人工冬眠的一个重要里程碑,将为未来的临床。
有鉴于此,在现实中,很多科学家正在不断破解冬眠的秘密,以期未来能够实现“人工冬眠”。科幻电影中,“宇航员躺进休眠舱,进入休眠状态以度过漫长的太空旅行”的想象或许在未来可以真的实现。届时,全球都将迎来一项具有里程碑意义的发明。早前,美国宇航局就资助了一项“人工冬眠”技术的研发,在漫长的星际旅行中让宇航员进入短期冷冻休眠状态。
神经调控体温,诱导人类冬眠
近日,“人工冬眠”技术又取得了重要进展,中国科学院深圳先进技术研究院脑所/深港脑科学创新研究院王虹和戴辑团队***在非人灵长类动物中实现了基于***神经调控的稳定体温调节,揭示了下丘脑视前区在灵长类动物体温调控中的作用,绘制了体温降低过程中全脑特异性激活的神经网络,以及灵长类动物对抗失温的保护机制,为潜在的临床转化和空间应用提供研究基础。
该项研究成果以“Primate preoptic neurons drive hypothermia and cold defense”为题发表在The Innonation上。

图1 研究成果
随着神经科学研究的进步,下丘脑视前区(POA)逐渐成为“人工冬眠”领域的研究热点。有研究表明,在转基因小鼠脑内,特异性激活POA脑区神经元,可以促使小鼠在1至2个小时内体温降至28℃,且这一低温状态可以维持十多小时。这种调控还促进小鼠增加散热、降低心率和活动量,这一现象与小鼠的自然休眠类似。因此,特异性激活相同脑区,或许可以在非灵长类动物中实现同样的效果。
在此项研究中,研究人员利用化学遗传学工具,以非人灵长类动物猕猴为模型,展开神经调控体温研究。研究人员通过功能核磁共振成像的方法评估了下丘脑视前区激活前后全脑水平的神经网络变化,***终他们发现,激活POA脑区一类进化保守的兴奋性神经元可以促进动物体温降低。
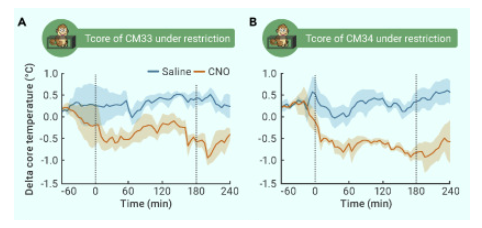
图2 激活猕猴POA神经元降低体核温度
研究人员还发现,非人灵长类动物对体温变化非常敏感,当其体温降低约0.5℃的时候,非人灵长类通过加速心率、肌肉颤栗、收缩外周血管等调节形式进行自主神经机制产热,以抵抗体温降低。同时,它们还会大幅增加运动量(图3),通过运动产热以抵御温度降低。
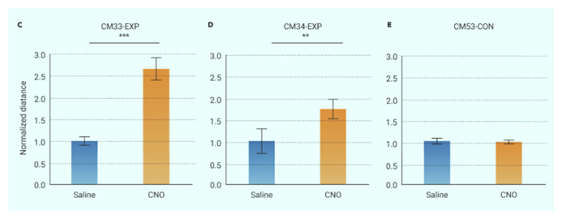
图3 猕猴体温下降与步行运动增加同时发生
接下来,研究人员对猕猴进行了功能性磁共振成像扫描,评估POA被激活前后其全脑水平的神经网络变化,以了解POA调控体温的脑网络机制。他们发现,化学遗传激活方法激活了POA局部网络,也同时激活了与温度、心率以及内感相关的多个核团。基于此,研究团队绘制出了非人灵长类动物体温降低期间,其全脑特异激活的神经网络。
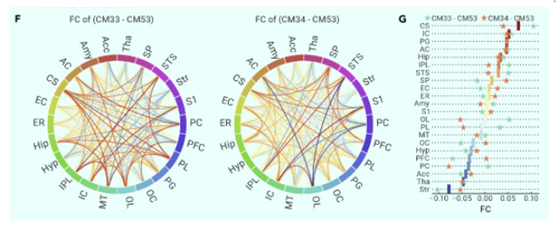
图4 体温降低期间,猕猴全脑功能连接的变化
在该项研究中,通过操控下丘脑兴奋性神经元,***实现了灵长类动物的温度调控,并通过功能性核磁共振成像技术描绘了温度调节时大脑的神经网络连接,这一低温模型或许是通向人工冬眠的一个重要里程碑,将为未来的临床转化和相关应用提供实验支撑。
DNA提取磁珠可以有效的从标本中提取基因组DNA、病毒DNA或游离DNA,采用化学合成的方法将四氧化三铁进行特殊的处理,使其粒径达到均一化分散,再通过特殊的材料进行官能基团(如硅羟基、羧基)的包覆。包覆官能基团后,磁珠具备了核酸吸附能力,配合核酸提取仪,可以自动化的提取DNA和RNA。