联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
“人类又偷偷进化不带上我?”
虽然是个段子,不过新研究发现,人类的基因整体确实发生了进化——
来自欧洲的一群科学家对新发布的人类基因数据集进行了研究,发现了155个“独特”的基因。
要知道,虽然新基因也可以从基因重复(复制基因)事件中诞生,即含有基因的DN***段发生重复,但这155个新基因却是“凭空出现”的。
这些基因虽然非常小(microgenes),但对人体的作用却不可忽视,有些甚至与人类的某些特异性疾病有关,包括肌肉萎缩症、色素性视网膜炎等。
目前,这项研究正式登上《细胞》子刊Cell Reports,通讯作者之一Aoife McLysaght兴奋地表示:
这是一个全新的领域。这些基因往往被忽略,因为它们很难研究,但人们会越来越意识到它们是需要被关注和考虑的。

那么这些新基因究竟是什么,它们又长啥样?
这些新基因是什么?
这些新基因的出现,***初“并不起眼”——是以sORF的形态出现的。
ORF(open reading frame),全称“开放阅读框”,是基因序列的一部分,包含一段可以编码蛋白的碱基序列。
sORF(small ORF)顾名思义,则是一种体积非常小的ORF,一般由不到300个核苷酸构成。
虽然大部分sORF的出现只是一种生物噪声(导致细胞内mRNA和蛋白质产生变化的一种生化反应),但许多依旧具有编码微蛋白(microprotein)的潜能。
但sORF毕竟太小了,此前受限于技术,一直被研究得不多,大部分基因也都没有被注释,更别提用它编码出的微蛋白了。
然而,微蛋白的研究对于生物研究又是不可或缺的。
毕竟对于某些已经有研究的生物学过程,微蛋白很可能也会参与其中,并在生理和病理过程中发挥重要作用,然而这些作用此前却是未知的。
随着技术的进步,不少生物科学家们开始尝试重新探索这一领域,试图通过研究微蛋白,来探讨它们对人类健康和疾病造成的影响。
根据长期对比观察微蛋白,科学家们找到了一些sORF序列,这些序列具有高度保守性,被称为高度保守序列(highly conserved)。
高度保守序列,指在不同类型生物体中非常相似的DNA序列。研究认为这些跨物种的相似性,可以证明某个基因完成了不同生物中的共同基本功能,因此在进化过程中保留了这些序列。大多数研究都会排除非保守性、新颖的基因序列。
这次,欧洲科学家们就基于一个从非规范ORF转译而来的微蛋白数据集,重构了人类微蛋白的进化起源。
结果,还真发现了不少此前没注意到的基因。
44个与生命健康有关
首先,科学家们根据数据集,将这次发现的新基因与四种类人猿(apes)的基因进行了比较。
类人猿包括黑猩猩(chimpanzee)、大猩猩(gorilla)、猩猩(orangutan)和长臂猿(gibbon)。
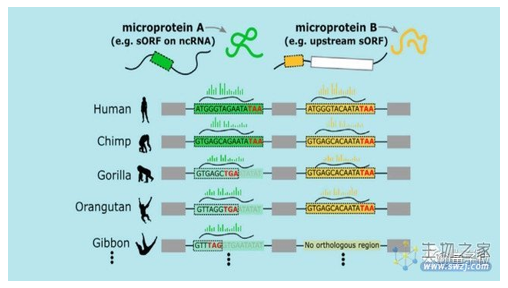
根据祖先序列重建(ASR,ancestral sequence reconstruction),研究者们发现,与其他几种类人猿动物相比,人类这些新生成的基因确实是从无到有(de novo)产生的:
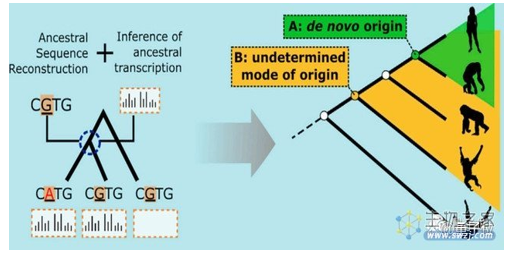
整体与各种脊椎动物进行对比后,研究人员发现了155个新的微基因,其起源和表型如下图:
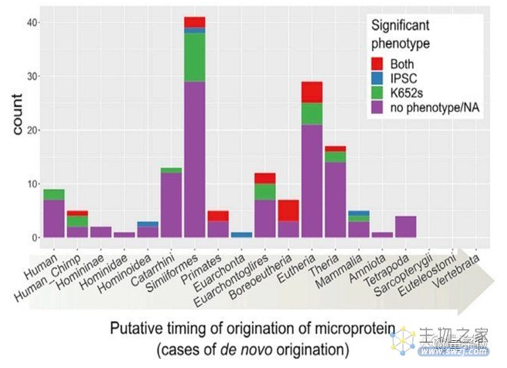
具体来说,在这155个新基因中,有44个与细胞培养物中的生长缺陷有关。
值得一提的是,这44个基因之前并没有被科学家们重视。论文介绍称,包括PhyloCSF在内的比较基因组学方法,都没有将它预测为一个保守的蛋白质编码区,即能发挥功能性作用的。
然而,这些基因却在维持生命系统健康过程中扮演了重要角色。
除此之外,科学家们还发现了3个包含与疾病相关DNA标记的基因。
这些标记分别与肌肉萎缩症、色变性视网膜炎和阿拉基综合征有关联。
这三种基因的起源中,肌肉萎缩症可以追溯到类人猿下目(Simiiformes),色素性视网膜炎则能被追溯到羊膜动物(Amniota)。
至于阿拉基综合征,此前被认为是人类特异性的,但直系同源基因也在黑猩猩中被转录,推测起源于人类和黑猩猩的共同祖先。
除了疾病,研究人员还发现了一种与人类心脏组织密切相关的新基因。
生物磁珠对细胞筛选的方法已日渐成熟,原理是将包被一抗的磁珠与细胞表面对应的分子特异性结合,或者将包被二抗的磁珠与已经与细胞表面分子特异性结合的一抗结合。磁珠携带与之结合的细胞吸附与分离柱或试管上,实现阳性细胞或阴性细胞的分离。洛阳吉恩特生物自主研发生产了各类生物磁珠,可以实现稳定的实验结果。