联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
大多数癌症表现出非整倍性,但其在肿瘤发展中的功能意义存在争议。美国耶鲁大学JASON M. SHELTZER团队在Science 在线发表题为“Oncogene-like addiction to aneuploidy in human cancers”的研究论文,该研究报道了RedACT (使用CRISPR靶向恢复非整倍体细胞中的二倍体) ,这是一套染色体工程工具,允许从癌症基因组中消除特定的非整倍体。
使用ReDACT,该研究创建了一组具有或缺乏常见非整倍体的同基因细胞,并且证明染色体1q 的三体对于携带这种改变的癌症的恶性生长是必需的。机制上讲,获得染色体1q会增加MDM4的表达并抑制p53信号传导,并且该研究表明TP53突变在人类癌症中与1q非整倍性相互排斥。因此,肿瘤细胞可以依赖于特定的非整倍性,这增加了这些“非整倍性依赖”可能作为治疗策略的可能性。
染色体拷贝数变化,也称为非整倍性,是肿瘤基因组的普遍特征。虽然非整倍体在癌症中的普遍性已经为人所知,但非整倍体在肿瘤发展中的作用仍然存在争议。染色体增益已被提出作为增加在改变区域内发现的肿瘤促进基因剂量的机制,然而,这一假设的证据不足,并且有替代性建议,非整倍性可能是由于在晚期恶性中经常发生的检查点控制的丧失而引起的。事实上,由21号染色体三重引起的唐氏综合症患者患大多数实体癌的风险显著降低,这表明在某些情况下,非整倍体实际上可能具有肿瘤抑制特性。
在过去的40年中,癌症研究人员已经使用分子遗传学的标准工具,包括基因过表达,敲低和诱变,以发展对许多个体癌基因和肿瘤抑制因子的深刻理解。例如,KRAS和TP53等基因的生物学功能部分通过创建和分析表达或缺乏这些基因的同基因细胞系。然而,现有的单基因操作方法不足以同时影响数百个基因的染色体尺度变化。从人类癌细胞中消除特定非整倍体染色体的后果尚未确定。
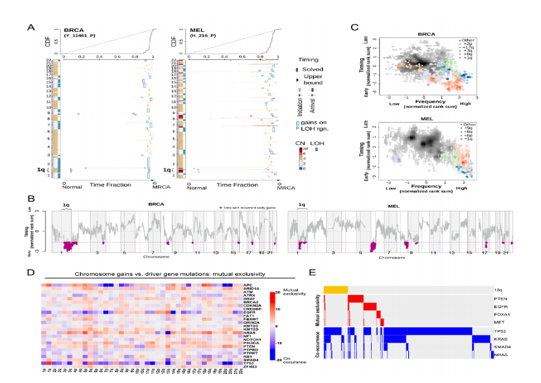
特定的染色体增益出现在肿瘤发展的早期,并且与驱动基因突变相互排斥(图源:Science)
对单个癌症驱动基因的研究导致发现了一种称为“癌基因成瘾”的现象,其中单个癌基因的丢失或抑制足以诱导癌症消退。例如,KRAS突变导致胰腺癌的发展,并且在“KRAS成瘾”胰腺肿瘤中遗传消融KRAS会阻止生长并触发细胞凋亡。以前的癌症基因组测序项目已经揭示了在人类肿瘤中观察到的非整倍性模式是非随机的,并且像染色体1q和8q的增益这样的特定事件比偶然预期的更频繁地发生。作者推测,这些复发性非整倍性本身可能代表一种癌症“成瘾”,类似于癌基因成瘾的概念。
DNA提取是分析农作物分子生物学性状的重要步骤,现阶段,常用的DNA提取技术有磁珠法和离心柱法,使用磁珠进行农作物的DNA提取,可以实现高通量、自动化的操作。由于磁珠对核酸的吸附灵敏度高,只需要少量的叶片或其他组织即可得到高得率、高纯度的DNA。吉恩特生物采用自主研发生产的纳米生物磁珠和磁珠法DNA提取试剂盒,可以从各种类型的农作物中提取高质量的核酸,配合核酸提取仪,可以达到快速自动化提取的目的。