联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
上千碱基对大小的DNA生产是合成生物学(例如基因治疗、代谢工程和DNA数据存储等生物技术)中design-build-test-learn (DBTL) 工作流程的重要组成部分。尽管近年来研究人员在DNA从头合成方面取得了显著进展,目前的方法仍然受限于产物DNA的大小、准确性、合成规模以及成本等因素。除开DNA从头合成技术外,市场上现有的突变体试剂盒也只能在非常有限数量的位点上产生突变,并需要耗时且难以进一步扩展的克隆步骤。而其他用于产生突变体的方法(包括重组、碱基编辑器或prime编辑)涉及复杂结构的组装,不易于应用于产生多种不同类型以及位点的突变。由于上述的这些***,即便研究人员现在能够通过机器学习算法设计更多突变体,我们还是无法有效地构建以及测试这些突变体DNA序列,并且这种在设计和验证上的技术差距正在不断增大。
美国哥伦比亚大学Harris H. Wang团队(共同一作为博士后研究员刘力源和黄义鸣)在Nature Methods上发表了文章Fast and efficient template-mediated synthesis of genetic variants。在这项研究中,他们开发了一种基因突变体诱变/合成策略,能够低成本且快速地合成基因突变体。

以下是该研究的具体内容:具有3’到5’校对活性的DNA聚合酶,如Q5®高保真DNA聚合酶,对尿嘧啶脱氧核糖核苷酸具有很强的结合亲和力,从而导致DNA聚合过程会在在含有此种核苷酸的位点停止。然而,经过修改的DNA聚合酶Q5U在其尿嘧啶结合口袋(binding pocket)中含有特异性突变,使其能够扩增含有尿嘧啶和肌苷碱基的DNA模板。通过利用这种属性,他们开发了一种新的体外基因突变体合成平台,称为模板引导的诱变扩增子组装Mutagenesis by Template-guided Amplicon Assembly (MEGAA)(图 1)。
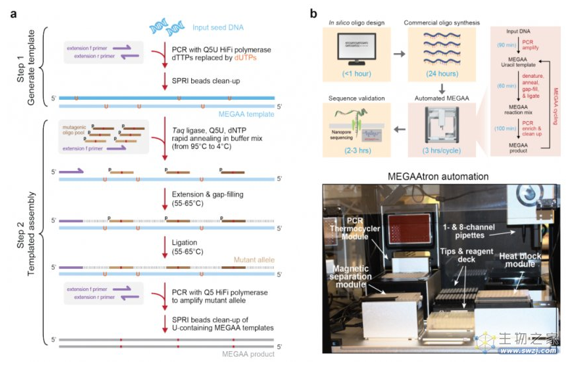
图 1 MEGAA合成DNA突变体的工作流程和自动化
在MEGAA中,首先通过将突变的寡核苷酸与含有尿嘧啶的模板DNA退火,使用Q5U延伸这些寡核苷酸,再使用Taq DNA连接酶将它们在同一反应体系中连接。这个过程允许每个寡核苷酸轻松引入6-8个核苷酸错配和插入突变以及多达6-20个核苷酸的缺失突变。接下来,研究人员通过利用Q5®DNA聚合酶进一步扩增MEGAA反应中的产生的变异扩增子,该过程因为Q5聚合酶的特性而不受原始含有尿嘧啶的模板DNA的干扰。***终的产物可以直接用于下游应用。MEGAA能够以***率(>90%每个目标位点)而可预测地方式在千碱基对的DNA中生成大量突变。更为巧妙的是,上一轮MEGAA反应的产物可以直接作为下一轮反应的输入,从而迭代循环MEGAA反应以调节所需产品的基因型纯度(以及所需的额外组合变异)(图2)。
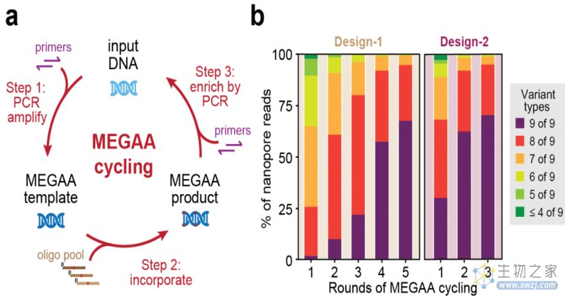
图 2 MEGAA迭代循环和优化设计
此外,他们还开发了一个开源的实验室自动化工作流程MEGAAtron,以便于DNA突变体的桌面生产和长读长序列验证。他们演示如何通过使用MEGAAtron快速合成31个新冠病毒刺突蛋白突变体和10个每个包含多达150个突变位点的4 kb重新编码的大肠杆菌DN***段。***后使用该系统轻松构建125个预设计具有不同突变位点组合的AAV2 cap基因突变体,与野生型相比,一些新合成的突变体的病毒包装效率提高了10倍(图3)。该系统已实现自动化工作流程,支持96孔板上的平行反应,24小时连续运行,从而快速合成/诱变所需突变体DNA。
生物磁珠对细胞筛选的方法已日渐成熟,原理是将包被一抗的磁珠与细胞表面对应的分子特异性结合,或者将包被二抗的磁珠与已经与细胞表面分子特异性结合的一抗结合。磁珠携带与之结合的细胞吸附与分离柱或试管上,实现阳性细胞或阴性细胞的分离。洛阳吉恩特生物自主研发生产了各类生物磁珠,可以实现稳定的实验结果。