联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
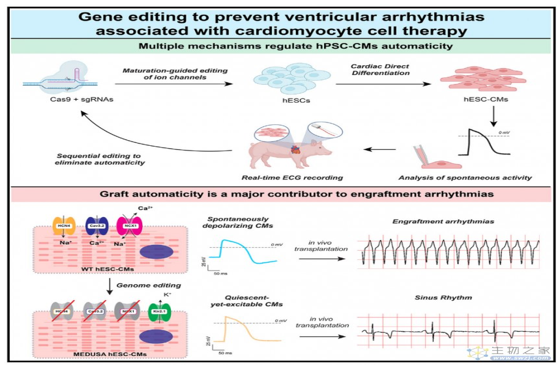
心脏是人体***重要的器官之一,为循环系统提供动力。而每年约有1.2亿人患有缺血性心脏病,这是全球死亡和住院治疗的主要原因之一。但是人的心脏在出生后不久就失去了再生能力。近年来,多能干细胞 (pluripotent stem cells,PSCs) 的发现为心肌梗死的治疗和心力衰竭的预防提供了一种有前景的方法。PSCs可以快速和大规模地分化成为高纯度的人多能干细胞来源的心肌细胞 (Human pluripotent stem cell-derived cardiomyocytes,hPSC-CMs)。心肌内移植的hPSC-CMs可帮助改善疾病模型心脏的收缩功能,这在小鼠、大鼠、豚鼠和非人灵长类动物中的心肌梗死模型都得到验证。然而,与正常CMs相比,早期的hPSC-CMs表现出自发和有节奏地去极化和引发动作电位的能力 (action potentials,APs),称为植入性心律失常 (engraftment arrhythmias,EAs)。对人类及猪这类心律敏感的动物来说是严重的损伤。如将hPSC-CMs移植到猪模型中,动作电位引发的短暂但严重的心律失常,这阻碍了细胞治疗技术应用于临床治疗。因此,EA的预防对细胞治疗心肌梗死至关重要。
近日,来自华盛顿大学的Charles E. Murry研究团队在Cell Stem Cell上发表题为Gene editing to prevent ventricular arrhythmias associated with cardiomyocyte cell therapy的文章,发现基因编辑后的hPSC-CMs移植到猪心脏中,不会产生EA且功能正常。这项研究发现hPSC-CMs的不成熟的电生理特性是造成EA的原因。因此,植入性心律失常的改善提高了hPSC-CMs用于心肌梗死治疗的安全性。

首先作者比较了早期hPSC-CMs的AP与成熟CM的AP具有多个显著差异。hPSC-CMs的成熟直接影响AP水平,这与离子通道表达的变化有关。接下来,他们通过RNA-seq揭示hPSC-CMs在体内成熟过程中与体外长期培养的CM具有显著表达差异。结果表明,在hPSC-CMs中,模拟诱导成熟细胞的离子通道基因表达可以降低自发的动作电位,并可能减少移植后EA的负担。随后他们通过药理学研究进一步验证。
这些离子通道可能在hPSC-CMs诱导自发的动作电位中发挥重要作用。随后作者根据转录组结果和药理学证据,对编码这些离子通道的候选基因进行了基因编辑。作者发现,单个基因的遗传操作均不能预防和阻止自发的动作电位和EA,表明可能需要多个离子通道的共同作用。且发现完全静息状态可能是消除EA所必需的。
原文链接:https://doi.org/10.1016/j.stem.2023.03.010
经过作者团队的不断探索和研究,他们构建了四重基因编辑(HCN4/CACNA1H/SLC8A1 3KO/KCNJ2 KI) 的hESCs,并将这个细胞系称为MEDUSA(modification of electrophysiological DNA to understand and suppress arrhythmias)。经过实验发现,MEDUSA hESCs-CMs在基线条件下处于静止状态,同时仍能在刺激时激发APs。这表明MEDUSA具有预防EA的可能性。
为了验证MEDUSA hESC-CMs在预防EA方面的功效,作者将其移植到猪的心脏。他们发现,移植后95%的时间,猪都处于稳定的窦性心律,只有零星的出现心室早缩和极少的非持续性心动过速。移植后前2周,与WT型hESC-CMs相比,MEDUSA型hESC-CMs出现EA程度显著减少。这些结果表明,MEDUSA hESC-CMs在体外几乎完全抑制的自发诱导动作电位,在体内可以有效缓解EA的发生。
总的来说,这项研究揭示了细胞治疗心肌梗死造成的植入性心律失常的预防措施,即通过CRISPR筛选证明,靶向兴奋性通道HCN4、CACNA1H和SLC8A1并表达抑制性通道KCNJ2可生成静态但可激发的心肌细胞,这些心肌细胞植入而不产生植入性心律失常。因此,提高了临床应用干细胞治疗心肌梗死的安全性和可行性。
RNA提取磁珠属于纳米生物磁珠的一种,主要作用是用于核酸提取过程中的RNA提取,粒径分布在500nm左右,是洛阳吉恩特生物自主研发生产的高分子纳米磁性微球,该磁珠悬浮时间长,磁响应时间迅速,对DNA甲基化过程中的提取环节提供良好的支持,可明显缩短实验时间,提高实验效率,并在提取结果上保持稳定,配合核酸提取仪,更能实现快速的RNA提取。