联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
Vertex Pharmaceuticals 和 CRISPR Therapeutics 宣布,美国食品药品监督管理局(FDA)接受CRISPR基因编辑疗法exagamglogene autotemcel(exa-cel)治疗严重镰状细胞病(SCD)和输血依赖性β-地中海贫血(TDT)的生物制品许可申请(BLA),同时授予其治疗SCD的优先审评资格。
据悉,这是FDA受理的***CRISPR基因编辑疗法上市申请。

Vertex公司***执行官兼总裁 Reshma Kewalramani 博士表示,非常高兴FDA接受exa-cel的申请并对其治疗SCD授予优先评审资格,exa-cel有望成为***获批的CRISPR基因编辑疗法,我们将继续努力工作,将这种具有变革潜力的治疗方法带给正在等待的患者。
CRISPR公司***执行官 Samarth Kulkarni 博士表示,很高兴看到FDA授予exa-cel治疗SCD的优先评审资格,这也是CRISPR平台的一个令人兴奋的里程碑时刻,期待继续与Vertex密切合作,将这种药物带给有需要的患者。
而在欧洲药品管理局(EMA)也已受理exa-cel的上市申请。这意味着,exa-cel有望于今年在欧洲获得批准。
exa-cel是由CRISPR公司和Vertex公司合作开发的一款用于治疗镰状细胞病和β-地中海贫血的基于CRISPR-Cas9基因编辑的自体细胞疗法,能够帮助患者有效摆脱输血和血管阻塞危机。
exa-cel疗法的临床试验数据此前于2020年12月发表在了《新英格兰医学杂志》(NEJM),论文题为:CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia。

治疗原理及临床试验结果
BCL11A是一种转录因子,可抑制红系细胞中的γ-珠蛋白和胎儿血红蛋白表达。因此,靶向抑制BCL11A在理论上可以重新激活γ-珠蛋白表达,从而治疗地中海贫血症和镰状细胞病。
研究团队从健康供体获得了CD34+造血干细胞和祖细胞,然后通过电穿孔导入特异性靶向BCL11A增强子的CRISPR-Cas9基因编辑系统。检测结果表明该位点的等位基因约有80%被编辑,且没有脱靶编辑的迹象。
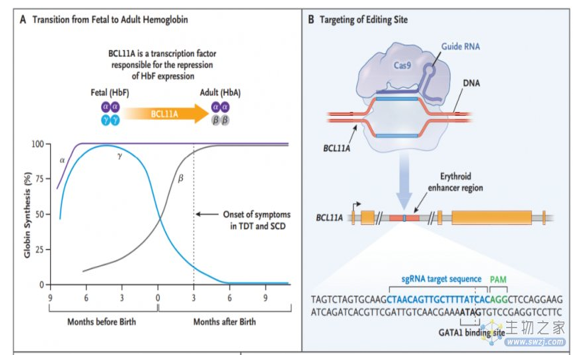
然后研究团队对1名β-地中海贫血症患者和1名镰状细胞病患者回输了经过CRISPR-Cas9编辑BCL11A增强子的自体CD34+细胞。
DNA提取磁珠可以有效的从标本中提取基因组DNA、病毒DNA或游离DNA,采用化学合成的方法将四氧化三铁进行特殊的处理,使其粒径达到均一化分散,再通过特殊的材料进行官能基团(如硅羟基、羧基)的包覆。包覆官能基团后,磁珠具备了核酸吸附能力,配合核酸提取仪,可以自动化的提取DNA和RNA。