联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
丹麦哥本哈根大学和新西兰奥塔哥大学的研究人员在国际***学术期刊 Nature 上发表了题为:Bacteriophages suppress CRISPR–Cas immunity using RNA-based anti-CRISPRs 的研究论文。
该研究揭示了病毒(噬菌体)抑制细菌的CRISPR-Cas免疫系统的全新方法——基于小非编码RNA的抗CRISPR(small non-coding RNA anti-CRISPR,简称Racr),这也是基于RNA的抗CRISPR的***个证据。
研究团队表示,这一发现告诉我们,自然环境中的的微生物动力学,可用于提升基因编辑的安全性,并有望带来更有效的抗生素替代品。这一发现对科学界来说是令人兴奋的,它让我们对如何阻止细菌的CRISPR-Cas防御系统有了更深入的了解。

CRISPR-Cas是细菌和古菌的免疫系统,可以保护它们免受病毒——噬菌体的感染。它的工作原理是在噬菌体入侵时获取其DN***段,并将其添加到细菌基因组中。细菌***终会拥有一个曾经噬菌体感染的记忆库,记忆库中新增的部分被CRISPR重复序列分开。当噬菌体再次发动攻击时,该系统就会快速识别和降解特定的噬菌体。
有趣的是,噬菌体也进化出来不同的方法来克服细菌的这种防御系统。它们之间一直在进行着进化的军备竞赛,细菌拥有CRISPR-Cas,而噬菌体则拥有抗CRISPR(anti-CRISPR)。早在2013年,多伦多大学的 Alan Davidson 教授团队就在 Nature 期刊发表论文【2】,发现噬菌体进化出了基于蛋白质的抗CRISPR来克服细菌的CRISPR-Cas系统。

之前的研究显示,一些噬菌体的基因组中也有着CRISPR重复序列。而这项***新研究发现了一种基于小非编码RNA的抗CRISPR(small non-coding RNA anti-CRISPR,简称Racr),Racr模拟在细菌的CRISPR阵列中发现的重复序列,并作为孤立重复单元编码在噬菌体基因组中。
研究团队发现,噬菌体编码的Racr通过与Cas6f和Cas7f特异性相互作用,强烈抑制I-F型CRISPR-Cas系统,导致异常的Cas亚复合物的形成,它们作为诱饵,破坏细菌的CRISPR-Cas防御系统。研究团队进一步确定了几乎所有由多种病毒和质粒编码的CRISPR-Cas类型的Racr候选基因,通常是在其他抗CRISPR基因的遗传背景下。
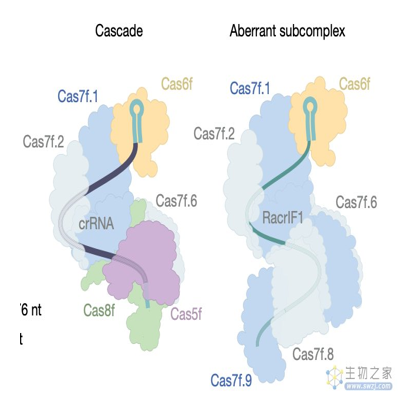
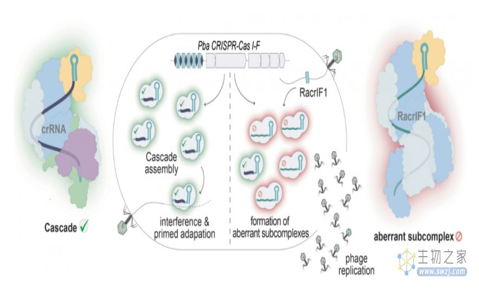
论文通讯作者 Rafael Pinilla-Redondo 教授表示,噬菌体自身的基因组中含有细菌CRISPR-Cas系统的成分,它们利用这些分子模拟物来沉默细菌的免疫系统,并允许噬菌体复制。
这项发现是基于RNA的抗CRISPR的***个证据,这比之前发现的基于蛋白质的抗CRISPR具有更短的基因序列。并且由于它们是基于已知的CRISPR重复序列,我们有可能为所有CRISPR-Cas系统及其特定应用设计RNA抗CRISPR。
RNA提取磁珠属于纳米生物磁珠的一种,主要作用是用于核酸提取过程中的RNA提取,粒径分布在500nm左右,是洛阳吉恩特生物自主研发生产的高分子纳米磁性微球,该磁珠悬浮时间长,磁响应时间迅速,对DNA甲基化过程中的提取环节提供良好的支持,可明显缩短实验时间,提高实验效率,并在提取结果上保持稳定,配合核酸提取仪,更能实现快速的RNA提取。