联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
近日,在中国新年来临之际,Science杂志推出了***新一期名为《Precision medicine and cancer immunology in China》的增刊,详细描述了中国精准医学的发展趋势及癌症免疫治疗的过去、现在和未来。数十位国内精准医学领域专家参与撰文,以下为吴一龙教授团队的撰文内容。
Precision cancer medicine and immunology in China
在临床肿瘤学的背景下,精准医学通过肿瘤基因和表观遗传学变化的信息来治疗病人。这种突变基因的典型例子包括表皮生长因子受体(EGFR)基因、肺癌间变性淋巴瘤激酶(ALK)基因、乳腺癌人类表皮生长因子受体2(HER2)基因、慢性粒细胞白血病(CML)中BCR-ABL融合基因等。在临床环境中,精准医学意味着为合适的病人根据合适的分子靶点选择合适的药物。精准医学极大的改变了临床实践并进一步完善了肿瘤治疗标准。
中国研究人员已经为EGFR和ALK基因突变非小细胞肺癌(NSCLC)标准疗法的建立做出巨大贡献。2009年,世界上***个3期研究显示了***代EGFR络氨酸激酶抑制剂抑制剂(TKI)药物对EGFR突变基因的肺癌患者具有疗效,这是肺癌研究和治疗中的一个里程碑。此后,中国开展了第二代和第三代EGFR-TKIs的进一步研究。除EGFR外,关于ALK、ROS1和其他所谓“驱动基因”的靶向药物对肺癌治疗效果的研究,已为具有特定基因组改变的病人建立新治疗标准提供了证据,这也促进了中国食品药品监督管理局(CFDA)对新药上市的审批。免疫疗法的研究也取得了迅速的进展,一些已经在美国及其他国家得到了审批。在中国,免疫疗法的早期临床试验正在进行,研究人员希望,在不久这些研究结果能够帮助免疫疗法通过CFDA的批准。由于一些同类药物在国际已获批准,此领域在中国竞争十分激烈。一些基于抗体的国产药物也参与到这一领域的竞争中,尽管相关项目仍处于早期试验阶段。
精准医学的进展已经改变了中国肿瘤治疗的实践,我们看到基因分型和基于TKI治疗更广泛的应用。同时,靶向治疗受一些因素影响,也可能在一些改进中获益。例如,中国患者选择并接受免疫治疗时也需要相关的监管机制和临床共识。
我们将在本文中探讨中国精准医学的现状,尤其是在肺癌治疗的应用。同时,我们还将在文中探讨该领域未来方向和战略。
精准医学在肺癌治疗中的应用
肺癌是一种高度异质性的疾病。中国肺癌患者中,主要的驱动基因包括EGFR、ALK、RET、MET、HER2、BRAF和KRAS,与美国国家综合癌症网(NCCN)发布的指南中列举的基因相似,但仍有显著的差异。例如中国患者EGFR突变率为35%,而白人患者中只有15%;中国肺癌患者KRAS突变率约为5%~10%,而白种人高达30%。其他发生频率较低的突变基因在人群中的患病率没有显著差异(图1)。
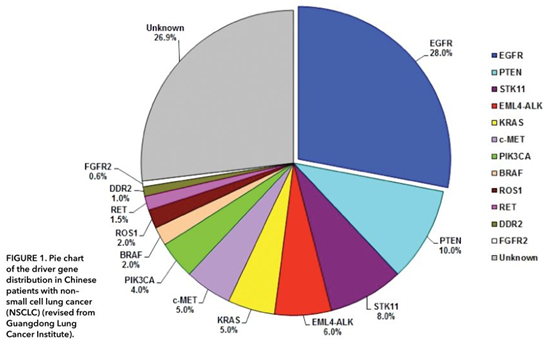
图1
2004年,EGFR被确认为肺癌靶向治疗的重要靶点。随着***篇关于中国人群中EGFR突变和TKIs反应率的初步数据的报道,莫树锦、吴一龙及其他中国研究者开展了具有里程碑意义的三期随机研究——吉非替尼(易瑞沙)泛亚洲研究(IPASS),其结果于2008年发表于《新英格兰医学杂志》。研究***次表明EGFR TKI对EGFR突变肿瘤患者治疗有效。根据IPASS及随后的研究,EGFR TKI被确立为具有EGFR突变肿瘤患者的标准一线治疗药物,被纳入包括NCCN、美国临床肿瘤学会(ASCO)及欧洲肿瘤医学学会(EMSO)在内的众多癌症组织制定的治疗指南中。2007年,肿瘤学家、国际肺癌研究协会(IASLC)主席、中国抗癌协会临床肿瘤学协作***委员会(CSCO)主席吴一龙教授创办中国胸部肿瘤研究协作组(CTONG)。协作组现有31家成员医院,已成开展临床试验和转化研究的重要平台,极大促进了中国靶向治疗的发展,不仅参与多个国际同步试验,而且在全国几十个研究起着主导作用。
上述研究支持靶向治疗在中国的注册和批准和设计开展试验的能力。CFDA已批准针对EGFR突变肿瘤的三种***代EGFR TKIs药物(盐酸埃克替尼厄洛替尼和吉非替尼),一种二代EGFR TKIs药物(阿法替尼),一种三代EGFR TKIs药物塔格瑞斯。克唑替尼,针对中国患者ALK和ROS1突变,也已通过CFDA的审批。其他一些ALK TKIs药物由CTONG研究者主导,目前正处于试验过程中,而针对许多其他突变基因TKIs药物也处于不同阶段的临床试验中或已在临床中使用。
肿瘤学新试验设计
靶向治疗***面临着一个现实的问题:他们如何确保具有足够数量特定基因改变的患者参与每种药物的临床试验?同时为患者筛查一组与该疾病相关的遗传生物标志物,并根据每一种特定的遗传或路径改变而匹配药物的想法现在已在全球范围内被采用。
CSCO主席吴一龙已提倡此类试验设计多年,尝试将分子基因分型和靶向治疗推向临床实践。2015年,吴一龙教授开展CLUSTER 1.0试验——亚洲***个多生物标志物驱动的临床研究,入选患者按遗传图谱分为不同治疗组,五种针对不同分子异常的药物研究构成试验的五个组,每组进行独立分析。如果药物反应率达到40%,则进行二期临床试验。此类多组并行研究的目的是降低整体药物筛选失败率。此项研究受到CFDA药物评价中心的高度关注,也是中国精准医学研究的一个重要里程碑。目前,CLUSTER 2.0肺癌研究的设计已完成,并将于2017年第四季度开始。CLUSTER 2.0仍然为一个多组研究,包含至少十组,用于评估新的特定基因或通路改变。
在开发新的抗癌药物如盐酸埃克替尼、阿法替尼、阿帕替尼的过程中,中国的研究人员已经积累了创新的临床试验设计经验。如旨在确定携带特殊EGFR突变患者阿法替尼安全计量和推荐二期计量(RP2D)的一项1/2期研究。不同于以往只使用***大耐受剂量,在这项研究中RP2D由药代动力学、初步的疗效与受试者的安全性决定。这种创新的设计建立了一个新的模式,允许在更大范围的剂量范围内显示早期疗效和低毒性。基于RP2D的快速测定,2016年研究者向CFDA申请开展阿法替尼的2/3期临床研究。
目前,CFDA仅批准了五种EGFR TKIs(吉非替尼、厄洛替尼、埃克替尼、阿法替尼、和奥希替尼)和一种ALK/ROS1 TKI(克唑替尼)。对于其他常见突变的肺癌患者,临床上仍没有可用的药物。因此,参加一项新的试验为这些病人提供了从精准医学获益的途径。事实上,通过这些不断创新的临床试验,具有可诉性基因改变的患者可以快速获取国际上正在研究的新药以及在美国、日本或欧洲批准的药物(中国未上市)。
生物标志物检测、诊断和治疗指南
在肿瘤精准医学中,分子诊断仍走在治疗之前。EGFR和ALK检测以及相应的治疗方法,已被纳入许多癌症协会的指南中,如NCCN、ASCO和ESMO。国际肺癌研究协会也发布了EGFR和ALK检测图谱及关于分子检测的一系列共识文件。
目前,中国已发布了不同类型肿瘤的相关指南。从2016年起,CSCO领导编制了肺癌及其他肿瘤患者诊断及治疗指南年刊。国家卫生和计划生育委员会也组织了国内专家为肺癌患者诊断和治疗提供临床路径和指导方针。由于与肺癌相关,吴一龙教授在编译这两个指南中都扮演了重要的角色。在CSCO指南中,由于药物和检测技术的局限性及资源分配的不均衡性,只有EGFR突变和ALK、ROS1重排及其靶向药物被纳入常规临床实践中。该报告认为,从血浆中循环肿瘤DNA作为一种替代生物材料来指导肿瘤取样以筛选EGFR突变,但它强调了产生假阴性的可能。由于新临床试验进展产生新的证据,检测、诊断及治疗的国际及国内指南每年都进行修正。
几种EGFR和ALK基因检测试剂盒已获CFDA批准上市,其他国家也在指南中推荐。根据一项尚未发表的报告,中国对患者的EGFR突变检测率是50%左右,虽然高于过去但仍与西方发达国家、日本、韩国和新加坡速度不同。一些医院在本院经省卫生和计划生育委员会许可的实验室中使用***近获批的试剂盒或内部开发的方法进行检测;一些资源短缺的医院外包给第三方实验室的分子检测。随着先进的新一代测序(NGS)技术的广泛应用,许多公司正在全国各地提供服务。ASCO生物标志物委员会,由吴一龙、张旭超领导的CSCO标志物委员会正关注和努力规范NGS技术的临床应用并保证临床肿瘤学实践检验的质量。在即将发布的NGS在临床肿瘤学中应用共识草案中,NGS技术被视为一个复杂的基因分型工具,其关键在于质量控制。此外,基于NGS应用患者的特定基因突变的诊断试剂盒目前被许多公司开发,在CLUSTER2.0试验中将作为标准诊断工具进行验证。
患者有除EGFR、ALK、或ROS1外驱动基因或遗传改变,CSCO指南推荐参与临床试验,使用研究中的药物。与疾病的复发或那些耐可用TKIs鼓励病人进行额外的分子筛选阐明耐药机制和参与临床试验相关的诊断。推荐复发和已有TKIs耐药患者进行额外的分子筛查已查明耐药机制并参加与其诊断相关的临床试验。中国精准医学已在治疗EGFR、ALK和ROS1改变肺癌中取得了实质性进展,中国研究者在国际及国内靶向治疗标准制定方面做出了重大贡献。然而,如果精准肿瘤学想要更好的发展,在提高EGFR等关键驱动基因的检出率,开发新药,开展新的试验,并使分子测试标准化等方面付诸更多的努力。
肿瘤免疫学
从百年以前免疫肿瘤学建立起,免疫治疗已在国际上被公认为有潜力的强有力的治疗手段。在美国,欧洲,和日本,免疫检查点抑制剂,如靶向CTLA-4、PD-1和PD-L1,已知抗癌抗T细胞蛋白已被监管机构批准应用于癌症治疗,包括黑色素瘤及肺癌。截至2016年12月,美国食品和药物管理局(FDA)批准阻断PD-1通路治疗,包括nivolumab,pembrolizumab,atezolizumab,这种抑制剂的工作原理是去除免疫激活的制动器,阻断肿瘤微环境中免疫攻击的抑制。其他免疫检查点抗体,如TIM3和IDO抗体正处于临床前期或临床试验阶段。
肺癌免疫治疗
国内目前尚无被CFDA批准的PD-1或PD-1抑制剂,与美国相比,中国研发的免疫肿瘤生物制剂(蛋白质类药物)较为落后,与小分子药物领域相同。然而,国内正在进行各种包括肺癌在内的多种国内国际抗癌药物的临床试验。2013年1月1日至2017年4月6日,ClinicalTrials.gov270个针对非小细胞肺癌的国际临床试验PD-1/PD-L1抑制剂(包括pembrolizumab,atezolizumab,durvalumab在内)注册。这270个试验中,有61个涉及东亚,14个涉及中国,其中12个是跨国试验,有2个只评估中国患者。在入组中国患者的14项国际试验中,有6项涉及一线/初级治疗,4项涉及二线治疗(如果初级治疗无效),2项是辅助治疗研究,2项是仅使用中国患者的第1阶段研究。有5项关于atezolizumab的研究,4项durvalumab研究, 3项Pembrolizumab研究及2项nivolumab相关研究。值得注意的是,PD-L1表达在一些试验中是入组标准之一,但其他试验没有此标准,测定中应用不同的诊断抗体筛选平台。
不同的PD-L1的表达检测和截断值导致不同试验结果的比较非常困难。然而,令人鼓舞的是,中国的制药公司都在努力开发PD-1和PD-L1药物。随着CFDA新药临床试验审批监管框架改革,调整政策后更适合国际临床试验的进行,免疫治疗试验现在正在加速进行。截止至2017年1月7日,中国制药公司已经开发出8种PD-1或PD-L1抑制剂,4种治疗非小细胞肺癌在内的晚期实体肿瘤的药物已通过CFDA批准进行一期临床试验的。另外四种药物的临床试验目前正在审查中,在2016年12月,美国FDA批准进行皮下注射药物KN035 PD-1抑制剂的临床试验。
国内制药公司免疫肿瘤市场竞争十分激烈,截至2017年10月,共有来自14国内的企业17个靶向PD-1、PD-L1或CTLA-4免疫检查点抑制剂治疗一系列肿瘤。
免疫检查点抑制剂提高患者选择性
肿瘤微环境中肿瘤细胞或免疫细胞PD-L1蛋白表达在已被广泛用于作为辅助诊断,或在临床试验中被回顾性评价。患者PD-L1抑制剂治疗反应率从20%上升至40%-60%,比预计有小幅增长。然而,用免疫组织化学(IHC)方法检测PD-L1蛋白表达是利用不同平台、不同的抗体及不同评分方法,使得它难以比较不同试验的结果。Hirsch团队研究显示,通过在不同的平台上的PD-L1检测带来差异会导致PD-L1状态的错误分类。
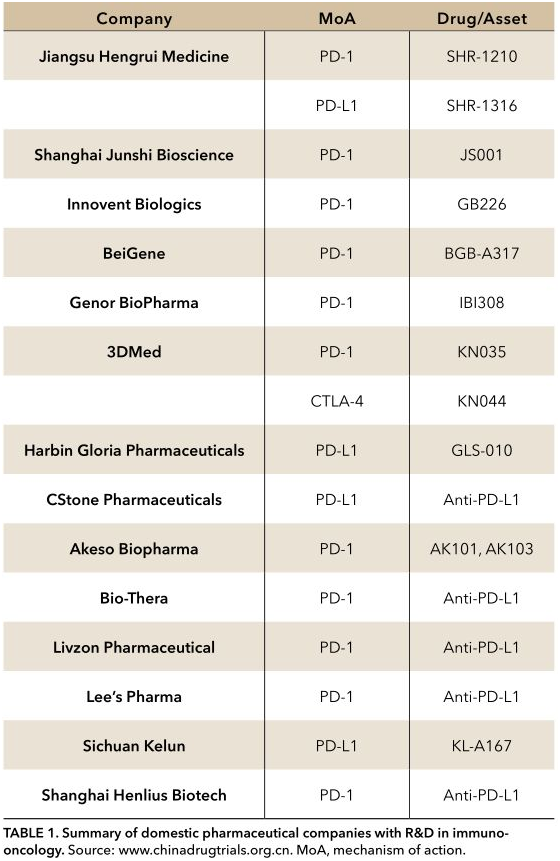
表1
国内尚无PD-L1蛋白表达检测或试剂盒被CFDA批准上市。CSCO指南中尚未推荐任何肿瘤的PD-L1检测,PD-L1 IHC检测已被美国FDA批准。在中国这在进行的试验中,仅一项试验使用PD-L1检测技术作为排除标准。PD-L1是否能够成为中国病人PD-L1抑制剂治疗的生物标志物仍需进一步研究。
中国人群中是否有除PD-L1之外的其他标志物呢?从理论上讲,肿瘤微环境中和循环血液中的分子可能是预测标记物。这种分子可能参与了抗原的出现和对肿瘤细胞的免疫攻击的许多步骤中的任何一个步骤。在多种癌症的试验中,生物标记物,如肿瘤突变负担、DNA错配修复状态、高微卫星不稳定性和循环T细胞特征等正在进行广泛的研究。
在国内正在进行的临床试验中,研究人员有很好的机会研究肿瘤和血液样本中提取的生物物质。在由吴一龙发起的一项研究中,研究人员通过分析从肿瘤中分离出的免疫细胞的RNA测序数据,研究了250名患有肺癌的重度吸烟者的免疫评分,初步数据显示免疫评分与疾病预后相关(未公布的数据)。这种基于RNA测序的方法可以在临床试验患者中进一步评估,以了解免疫评分是否能预测免疫治疗的阳性反应。需要注意的是,一些生物标志物需要多色IHC,全外显子测序,或癌基因面板这样复杂的技术。另一个挑战是如何整合多种免疫相关的生物标志物,例如,结合PD-L1表达及肿瘤突变负担。
总的来说,新的生物标志物的发展来预测和指导PD-1/PD-L1抑制剂免疫治疗需要进一步探索,特别是在患者能够提供生物标本及治疗随访数据可监控的临床试验中。
总结及未来方向
在过去的10年里,同许多其他国家一样,中国临床肿瘤学实践逐渐纳入精准医学分类,在临床研究和药物开发方面也取得了重大进展。中国研究者在国际研究方面作出了重要贡献,并根据东方人人群的特殊性进行了试验。合成了系列疗效良好的靶向制剂,并将其应用于临床。在免疫治疗领域,几十项国内和国际的试验正在推进PD-1/PD-L1抑制剂进入临床应用。来自中国本土公司的8种抑制剂正处于临床开发的早期阶段,用于对抗多种癌症类型。少数其他小分子TKIs和免疫检查点抑制剂正在进行临床试验。近年来,国家和地方制定临床实践指南,以规范这些有效的新疗法的使用。
尽管如此,中国在某些领域仍是滞后的,包括新药的开发等。此外,国内许多新型抗癌药物都是对已经上市或正在进行研究的药物进行结构改良,少见创新设计。
未来发展方向是多样的,医药行业应把***从一般代理转变为开拓型企业的发展。新技术如NGS和液体活检ctDNA,是促进创新型生物标志物驱动临床试验了的有效途径,特别是对那些癌症相关基因遗传变异罕见的患者。还应该更加关注导致抗EGFR和ALK TKIs的作用机制,以及可以克服这种阻力药物。更多关于包括检查点抑制剂和过继性细胞治疗在内的免疫治疗的平行研究仍需进一步探索。***后,发展临床生物标记共诊断和标准化生物标志物检测应成为***。
众所周知,要改进本土公司的药物研发,以及这些公司的竞争力,需要付出很大努力。中国政府的政策鼓励新药创新研发和培育初创公司。受美国前总统奥巴马倡导的精准医学和前副总统拜登启动的癌症登月计划的影响,中国发起了一系列国家科技计划激励研发肿瘤学精准医学项目。
为了进一步推动肿瘤学正确向前发展,所有利益相关者,包括政府、研究者、制药公司、创新生物技术公司、病人和为病人谋益者都应该聚集在一起,共同应用资源,只有这样,我们才能给***需要的病人带来***合适的药物。
除了检测技术本身的发展之外,相关辅助技术前处理技术的发展也至关重要。磁珠法核酸提取技术是自动化高通量的检测前处理技术,非常适用于现代化高通量样本检测技术的配套使用。吉恩特公司生产的磁珠法核酸提取试剂盒深受相关实验室好评。