联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
近期,来自于波士顿儿童医院的科学家们通过深入研究一种罕见的先天性遗传病——先天性纯红细胞再生障碍性贫血(又称Diamond-Blckfan综合征,DBA)找到了红细胞生成的新机制,并有望为这一罕见疾病带来新的基因疗法。
该研究,***次揭示:细胞内主管蛋白质生产的“车间”——核糖体(ribosomes)与造血干细胞分化有关联。
横跨80年的研究
1938年,波士顿儿童医院的Louis Diamond博士、Kenneth Blackfan博士***描述了Diamond-Blckfan综合征,这一严重、罕见的血液疾病典型的症状是贫血——红细胞生成受阻,从而影响全身的氧气输送。
40年前,波士顿儿童医院的David Nathan博士认为,这种疾病会特异性地影响血液干细胞生成成熟红细胞的过程。此后10年,同样在波士顿儿童医院工作的Stuart Orkin博士发现一种名为GATA1的蛋白质,证实它是负责血红蛋白(hemoglobin)生成的关键因子,后者是红细胞不可或缺的蛋白。
有意思的是,近年来,遗传分析显示,一些DBA患者携带有阻碍GATA1表达的突变基因。现在,“DBA致病机制”谜题的***后一部分由波士顿儿童医学的科学家们揭开。
“这一疾病在医院已有多年的研究历史。”团队负责人、血液学及肿瘤学家 Vijay Sankaran教授强调道,“现在,我们可以进入下一步——治疗。”
从天然的错误中找到答案
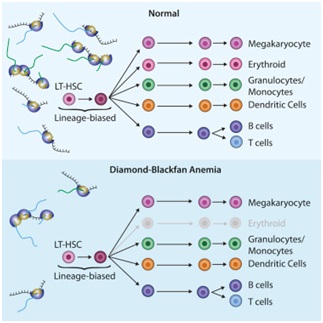
先前的研究已经表明,许多Diamond-Blckfan综合征患者都携带有核糖体蛋白基因突变。但是问题是:这些突变与GATA1蛋白有关联是否有关联?为什么仅仅影响红细胞的成熟?对于DBA患者,其他血液细胞,例如血小板、T细胞和B细胞,即便同样携带突变,依然发育良好。
“核糖体突变到底是改变其组成还是数量?这一直存在争议。” Sankaran解释道。现在,他们知道,答案是后者。
图片来源:Cell期刊
通过分析Diamond-Blckfan综合征患者的血液细胞样本,Sankaran团队发现,血细胞前体细胞内的核糖体数量直接影响细胞有效表达GATA1蛋白(血红蛋白生成、红细胞发育的关键元素)。
Sankaran团队终于将所有的“碎片”拼成完整的图——前体细胞内核糖体数量的减少,会遏制GATA1蛋白的表达,***终阻止其分化生成正常的红细胞。
基因治疗
新发现支持了一种假设,即造血祖细胞的GATA1蛋白有助于刺激它们分化成红细胞。如果没有足够的核糖体支撑GATA1蛋白的表达,这些祖细胞将无法启动红细胞发育的信号。
Sankaran相信,这一结果给予了“基因治疗纠正GATA1缺陷”的机会。他们希望能够验证这一假设。尽管骨髓移植可以治疗Diamond-Blckfan综合征,但是Sankaran认为,基因治疗有一定的优势,因为它利用患者自己的细胞(经过改造),避免了移植潜在的免疫排斥风险。