联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
2月,Science增刊上发表由吴一龙和张绪超团队发表的《Precision cancer medicine and immunology in China》一文,由10余位国内专家共同撰写,详细描述了中国精准医学的发展趋势及癌症免疫治疗的过去、现在和未来。
肺癌精准医疗
肺癌具有高度异质性。中国肺癌患者的主要驱动基因有EGFR、ALK、RET、ROS1、MET、HER2、BRAF和KRAS,与美国NCCN发布的指南名录中所列出的比较相似。但在基因突变频率上存在显著差异,中国患者EGFR突变率约为35%,白人患者仅为15%;中国肺癌患者KRAS突变率约为5%~10%,白人患者则为30%,其他突变频率较低的基因没有明显差异。
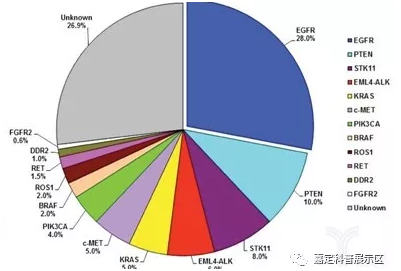
中国患者NSCLC驱动突变基因
2004年EGFR突变被确定为肺癌靶向治疗的焦点。中国研究人员进行了里程碑式的临床III期随机试验:易瑞沙泛亚研究(IPASS),并于2009年在《新英格兰医学杂志》发表,***证明EGFR TKI治疗EGFR突变的癌症是有效的。基于IPASS和后续研究,EGFR TKI被确定为EGFR突变肿瘤患者标准一线治疗,纳入NCCN、ASCO和ESMO等众多国际癌症组织治疗指南。
CFDA现已批准了3个***代EGFR TKI药物(吉非替尼,厄洛替尼,and埃克替尼),1个第二代药物(阿法替尼)和1个第三代药物(奥希替尼),用于治疗EGFR突变肿瘤。克唑替尼针对ALK或ROS1突变的中国患者,也获得了CFDA批准。与此同时许多其它突变基因的TKI也已进入不同阶段的临床试验或已进入临床使用。
免疫治疗
在中国,还没有PD-1或PD-L1抑制剂获CFDA批准。与美国相比,中国免疫肿瘤生物制剂(蛋白类药物)的研发落后于小分子药物领域。但多种临床试验正在积极研究治疗肺癌等多种类型的癌症的国际国内药物在中国患者中的效果。
2013年1月1日至2017年4月6日期间,ClinicalTrials.gov网站上共注册了270项用pembrolizumab、atezolizumab和durvalumab等PD-1/PD-L1抑制剂治疗非小细胞肺癌(NSCLS)的临床试验。14项纳入中国患者的国际试验中,6项一线/初级治疗、4项初始治疗失败后使用的二线治疗、2项辅助治疗以及2项仅含中国患者的临床I期试验研究。使用药物为5项Atezolizumab、4项durvalumab、3项Pembrolizumab和2项nivolumab。值得注意的是,某些试验设置PD-L1表达为招募标准,使用不同诊断抗体和筛选平台进行检测。
PD-L1表达检测和下限的不统一使得比较不同试验的结果非常困难。随着CFDA改革新药临床试验审批的监管框架,调整政策以应对国际临床试验的进展,如今免疫治疗试验进展更快。截至2017年1月7日,中国制药公司已研发出8种PD-1或PD-L1抑制剂,其中4种已通过CFDA批准,在NSCLC等晚期实体瘤患者中进行临床I期试验。另外4种正在临床试验审批阶段。2016年11月,皮下注射给药的PD-1抑制剂KN035,被美国FDA批准进行临床试验。
中国国内制药企业的免疫肿瘤市场竞争非常激烈。截至2017年10月,14家国内企业中有17种靶向PD-1、PD-L1和CTLA-4免疫检查点抑制剂进行不同种类的癌症治疗试验。
提高对免疫检查点抑制剂治疗患者的选择
肿瘤微环境中,肿瘤细胞或免疫细胞的PD-L1蛋白表达已被广泛用于伴随诊断或临床试验回顾性评估。用PD-L1表达水平选择的患者中,PD-L1抑制剂治疗的总体反应率从20%增加至40%~60%,但仍比预期增加偏小。这是因为利用不同平台、抗体和评分标准,通过免疫组化(IHC)检测PD-L1蛋白表达,使得不同试验的结果难以比较。Hirsch等报道,在不同平台上PD-L1检测差异会导致PD-L1状态的错误区分。
目前在中国还没有PD-L1蛋白表达检测或试剂盒获CFDA批准。CSCO指南也并不推荐针对任何类型的肿瘤进行PD-L1检测。与此相对,FDA批准了一项PD-L1 IHC检测。在中国进行的试验中,某些试验将进行PD-L1检测纳入标准,另一些则没有。PD-L1是否能作为中国患者选择PD-L1抑制剂治疗的预测性生物标记物还需要进一步的研究。
能不能开发出比PD-L1更适于中国人群的潜在生物标志物?从理论上讲,肿瘤微环境和循环血液中的分子可以做预测标记物。这些分子可能参与从抗原出现到对肿瘤细胞免疫攻击的诸多环节中的任何一步。肿瘤突变负荷(TMB)、DNA错配修复状态、微卫星高不稳定性(MSI)和循环T细胞特征等生物标记物在多种癌症试验中被广泛研究。
某些生物标记物需要使用像多色IHC、全外显子深度测序和癌基因panel等***技术。另一个挑战是如何整合多种免疫相关生物标记物,如PD-L1表达结合肿瘤突变负荷。
总的来说,还需进一步探索预测和指导PD-1/PD-L1抑制剂使用的新生物标记物,特别是从那些能提供持续样本及随访数据能被监测的患者中获得数据。
肿瘤学的新试验设计
靶向疗法的研发者面临一个现实问题:如何保证有足够数量特定基因变异的患者进入每种药物的临床试验?现在世界范围内采用的方式是,根据与疾病相关的一组基因生物标记物同步筛选患者,并根据每一种特定基因或通路的改变匹配药物。
多年来吴一龙一直倡导这种试验设计,并致力于推动分子基因分型与靶向治疗的临床应用。2015年,他启动CLUSTER1.0试验,***在亚洲进行多生物标记物驱动的临床研究。根据患者遗传图谱,将入选的患者分配到不同给药组。基于突变发现的五种靶向不同分子异常的药物,是研究的五个臂,每个臂都进行独立分析。如果对药物响应率达到40%,将进行第II期试验。多臂并行的试验是为了降低总体药物筛选的失败率。本研究受到CFDA药物评价中心极大关注,是中国精准医疗的重要里程碑。现已完成后续CLUSTER2.0肺癌试验设计,在2017年第四季度推出。CLUSTER2.0同样以生物标记物驱动,至少在10个研究臂评估新的靶向药物,这些研究聚焦于特定基因或通路的改变。
在研发icotinib,avitinib,apatinib等新抗癌药物过程中,中国研究人员推出创新的临床试验设计。其中一项临床I/II期研究针对携带特定EGFR突变的患者,确定avitinib安全性和推荐II期剂量(RP2D)。在这项研究中,不再使用通常的***大耐受剂量,RP2D改由药代动力学、初期疗效和药物安全性确定。这种创新设计建立了一个新模式,使得在早期更大剂量范围内显示疗效和低毒性。由于RP2D测定快速,2016年研究人员向CFDA申请批准avitinib的临床II/III期试验,这是中国有史以来速度***快的新药应用申请。
目前,CFDA仅批准了5种EGFR TKI。而其他常见突变的肺癌患者,并没有适应症内获批的药物。因此,参加一项新临床试验能为这类患者提供机会。并且通过不断创新的临床试验,基因突变的患者能快速并获取到有空性的尚处于临床或国外获批的药物。
总结及未来方向
过去10年里,同其他国家一样,中国临床肿瘤学实践逐渐迈入精准医疗时代,在临床研究和药物研发方面也取得重大进展。中国科研工作者为国际研究作出了重要贡献,并根据东方人种特点进行试验,合成一系列具有良好疗效的靶向药物应用于临床。在免疫治疗领域,几十项国内和国际试验,正将PD-1/PD-L1抑制剂推入临床。来自中国本土公司的8种抑制剂正处于临床开发的早期阶段,其它一些小分子TKI和免疫检查点抑制剂也正在进行临床试验验证。近年来,国家和地方的临床实践指南已规范新疗法的有效使用。
未来方向仍有多种可能。NGS和ctDNA液体活检等新技术可促进生物标志物的试验,尤其是对有癌症基因罕见遗传变异的患者。还要关注EGFR和ALK TKI耐药的作用机制,找到克服的办法。需要广泛地探索检查点抑制剂和过继性细胞治疗等免疫疗法。***后,需要解决生物标记物伴随诊断的临床发展和生物标记检测的标准化。