联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
基因组稳定性维持是一切生命活动的基础。细胞通过不断***来修补和替换受损组织。每一次的***都需要重新“复印”一次细胞的“遗传蓝图”。随着DNA的复制,“错印”不可避免地发生了。这种损伤若是置之不理,就会导致细胞的死亡。
ATR激酶负责启动细胞对基因组不稳定的响应和修复,一旦感应到DNA损伤和复制叉压力会迅速活化,直接磷酸化细胞内超过1000个重要底物(包括抑癌基因p53编码蛋白、细胞周期调控蛋白等),全局性地调控基因组的稳定。ATR及其参与的信号通路对基因组稳定,肿瘤的发生、发展和治疗至关重要。ATR激酶是如何响应DNA损伤的,又如何活化修复系统?解析ATR激酶的活化机制,是现代生命科学领域的核心问题之一。
基因组不稳定性和易突变是肿瘤细胞的一个基本特征,通常伴随着大量稳定和修复基因组DNA的功能缺失,因此癌细胞更加依赖ATR激酶。大量功能和临床前的实验数据表明ATR激酶抑制剂能直接***杀死肿瘤细胞;此外,常规的化疗和放疗更进一步加剧了肿瘤细胞的基因组不稳定性,抑制ATR活性能协同增强常规肿瘤治疗对癌细胞的杀伤活性。因此,ATR激酶抑制剂在癌症治疗上具有重要应用前景,目前已经有两种ATR抑制剂进入了临床试验,但是,现有抑制剂的特异性和稳定性有待加强;研制新型的ATR抑制剂在肿瘤治疗上具有重要临床应用价值和意义。
中国科学技术大学蔡刚课题组,与南京农业大学王伟武课题组合作,***揭示了ATR-ATRIP复合体的近原子分辨率结构,揭示了ATR激酶活化的分子机制,为研制新型ATR激酶抑制剂用于肿瘤治疗奠定了结构基础,该研究成果以“ 3.9 Å structure of the yeast Mec1-Ddc2 complex, a homolog of human ATR-ATRIP” 为题发表于12月1日出版的《Science》杂志上。
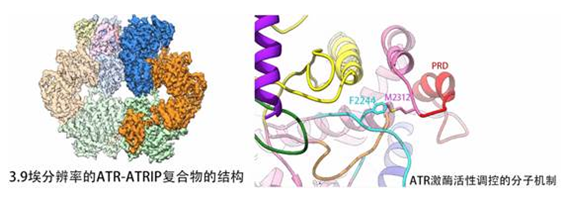
蔡刚教授课题组成功解析了来源酵母的ATR激酶及其结合蛋白ATRIP复合物(ATR-ATRIP)的近原子分辨率(3.9 Å)结构,发现细胞内的 ATR以ATR-ATRIP异二聚体的同源二聚体的形式存在。已鉴定的和ATR激活直接相关的ATR PRD结构域和ATRIPcoiled-coil构成了***主要的ATR-ATR和ATRIP-ATRIP同源二体的作用界面;鉴定了PRD和Bridge结构域是调节ATR生物学功能的关键位点,并发现这两个关键调节位点在mTOR,ATM和DNA-PKcs等激酶中高度保守;清晰揭示了在未激活状态下,ATR激酶的活化环(activation loop)被其PRD结构域,通过一个特异性的疏水性相互作用所锚定,因而,被锁定在待激活状态。ATR特异性激活蛋白可以利用其高度保守的疏水残基竞争性地解除PRD对活化环的抑制,迅速活化ATR的激酶。该成果不仅揭示了ATR激酶活化的分子机制,具有帮助阐明基因组稳定性调控机制的重大科学意义;也揭示了ATR激酶上PRD和Bridge等调控位点可用于指导新型ATR激酶抑制剂的设计,为肿瘤治疗新型药物的研发提供了重要结构基础。
该成果在揭示了ATR激酶活化的分子机制的同时也揭示了ATR激酶上PRD和Bridge等调控位点可用于指导新型ATR激酶抑制剂的设计,为肿瘤治疗新型药物的研发提供了重要结构基础。