联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
5月19日,由生物谷主办的“2018(第九届)细胞治疗国际研讨会”在 上海小南国花园酒店***闭幕。美国宾夕法尼亚大学的赵阳宾副教授受邀做了极为精彩的报告。
在生物谷主办的2018(第九届)细胞治疗国际研讨会上,赵阳兵教授发表了题为“Use CRISPR gene editing to improve T cell adoptive immunotherapy for cancers”的演讲,从通用型CAR-T细胞、NY-ESO-1 TCR的发展、使用PD1-CD28转换受体克服肿瘤微环境抑制和使用CRISPR文库筛选T细胞等四个方面,展示了CRISPR技术在CAR-T和TCR-T细胞中广阔的应用前景。
CRISPR(Clustered regularly interspaced short palindromic repeats)是一种细菌对抗外来入侵基因的免疫系统。外来基因整合进细菌的基因组后,会转录出一段RNA,可引导带有DNA内切酶活性的Cas蛋白寻找入侵序列,然后将该序列切除。后来,科学家们发现可以利用CRISPR/Cas9定向切除目标基因,从而达到基因编辑的目的。如今,廉价、快捷且操作简单的CRISPR/Cas9基因编辑系统已成为生命科学领域***热门的技术之一。
如果将CRISPR和CAR-T技术相结合,又会产生怎样的效果呢?赵阳兵教授也给出了答案——通用型CAR-T细胞(universal CAR-T cells)。为了避免免疫抑制带来的副作用,现阶段的CAR-T细胞治疗是高度特异性的。我们需要先获得患者自身的T细胞,在体外对T细胞进行修饰和扩增后,再把制备好的CAR-T细胞回输进特定患者的体内。整个过程耗时长且费用高,现已上市的两个CAR-T疗法报价均在40万美元左右。而通过CRISPR技术特定敲除T细胞的TCR, HLA-I, PD-1和CTLA-4后,理论上可以解除免疫系统对非自体来源的CAR-T细胞的抑制,使CAR-T细胞成为一种通用型的产品,从而实现大规模生产和成本降低的目标。并且有实验证明,使用CRISPR敲除TCR后,CAR-T细胞仍可保持应有的扩增能力和抗肿瘤效果。
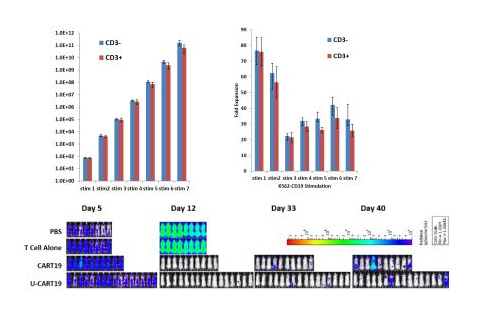
同时,赵教授也介绍了CRISPR技术在靶向NY-ESO-1的TCR-T 细胞的应用。天然筛选到的TCR一般活性较弱,而通过基因突变的方法可以提高TCR的亲和力和活性。但是,大多数高亲和力的TCR特异性会明显下降,从而导致其靶向性下降而产生严重的临床毒性。目前赵阳兵教授实验室主要采用的方法是用CRISPR技术敲除内源性TCR,从而增加转基因TCR的亲和力和TCR-T细胞的抗肿瘤能力。敲除内源性TCR的TCR-T在体外实验或小鼠肿瘤模型中,可以达到和亲和力增强型TCR一样好的效果,而不用担心脱靶副作用。
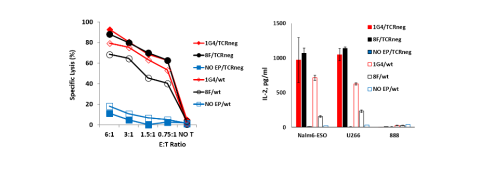
在肿瘤微环境中,有多种抑制T细胞增殖的机制,其中***常见的便是PD-1/PD-L1系统。但现在,我们可以通过分子生物学方法将PD-1的胞外区和CD28的胞内区链接起来,构建PD1-CD28转换受体(Co-delivering PD1-CD28 switch receptor),从而将抑制信号转换为刺激信号,大大增强了CAR-T在体内的增殖和抗肿瘤能力。
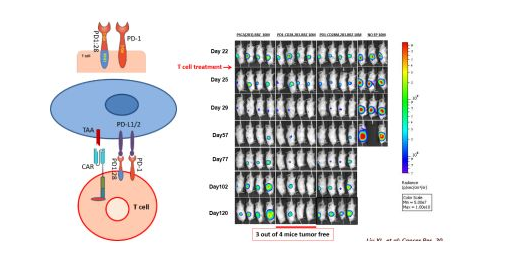
***后,赵阳兵教授介绍了CRISPR/CAR T文库在T细胞筛选中的作用。CRISPR/CAR T文库为多种T细胞的混合物,每种T细胞均被敲除了一个不同的特定基因。而CRISPR/CAR T文库检索可以帮我们定位新的潜在作用靶点。
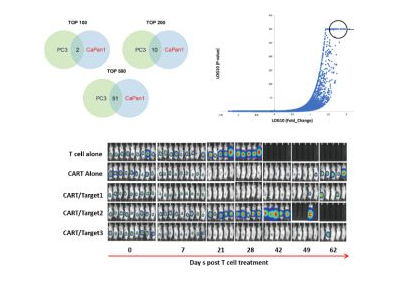
之后,赵阳兵教授实验室将把CRISPR技术应用到NY-ESO-1 TCR-T项目。这个项目主要是在T细胞中敲除内源性TCR和PD-1,再把靶向NY-ESO-1的TCR转入到T细胞内。项目的临床试验申请刚刚获得了美国FDA批准,也是美国***个使用CRISPR基因编辑技术的临床试验,计划将于年底展开。
基因编辑以基因提取及纯化为基础,吉恩特公司生产的生物磁珠及磁珠法核酸提取试剂盒,配合核酸自动提取仪,能够高通量自动化地进行核酸提取与纯化的过程。大大节省了人工,能够有效提高研究效率,降低时间成本,是相关研究小组的***。