联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
一款中国原创新药西达本胺(tucidinostat)有望为这部分晚期HR+乳腺癌患者带来新的希望。西达本胺用于乳腺癌的一项3期临床由解放军总医院第五医学中心江泽飞教授、复旦大学附属肿瘤医院胡夕春教授等专家团队带领开展,积极结果近日发表于《The Lancet Oncology》。

图片来源:《The Lancet Oncology》官网截图
研究显示,由表观遗传修饰引起的异常基因表达与乳腺癌进展和内分泌治疗耐药有关,而组蛋白去乙酰化酶(HDAC)抑制剂有望调节或逆转表观遗传修饰,以诱导癌细胞的细胞周期阻滞、分化和死亡,并改变肿瘤微环境。
西达本胺(tucidinostat)是由微芯生物自主研发,是国际***亚型选择性组蛋白去乙酰化酶(HDAC)口服抑制剂、国家1.1类新药。目前,tucidinostat已在中国被批准用于复发或难治性外周T细胞淋巴瘤,并且正在全球范围内针对各种癌症进行临床研发。在相关探索性研究中,西达本胺与依西美坦的联合疗法已经在晚期HR+乳腺癌患者中显示出良好的抗肿瘤活性,在次基础上,这项研究旨在通过更大规模的3期随机试验评估这一联合疗法的有效性和安全性。
研究在中国22个癌症中心开展,纳入了绝经后、HR+/ HER2-(人表皮生长因子受体2阴性)的乳腺癌患者,这些患者在至少一次内分泌治疗后出现疾病复发或进展。在2015年7月20日-2017年6月26日期间,共365名患者入组并2:1随机分配接受每周口服两次西达本胺30mg或安慰剂治疗,两组患者都同时每日口服依西美坦25mg。研究的主要终点是研究者评估的无进展生存期(PFS)。
中位随访时间为13.9个月。经研究者评估,西达本胺联用依西美坦的患者中位PFS为7.4个月,对照组为3.8个月,相比之下,西达本胺组患者的疾病进展风险降低25%(HR 0•75,95% CI 0•58–0•98,p=0•033),达到主要终点。在独立审查委员会的评估中,对照组差别不大,西达本胺组更具优势,中位PFS达9.2个月,疾病进展风险降低29%。
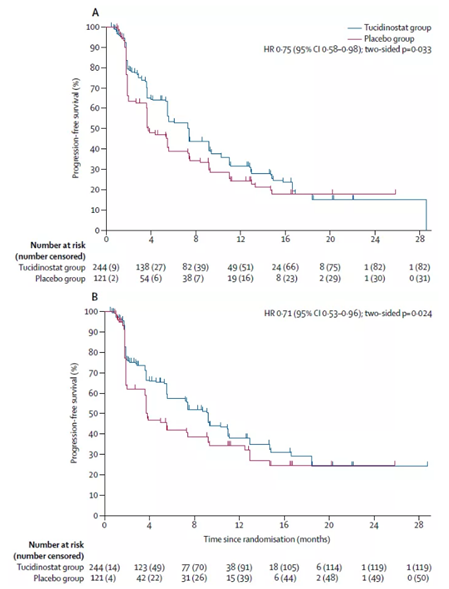
▲西达本胺联用依西美坦组的患者疾病进展风险更低,图A-研究者评估,图B-独立审查评估
西达本胺组的客观缓解率(ORR)也更高,为18%,对照组为9%。两组的中位持续缓解时间没有显著差异。西达本胺组中有临床获益的患者比例更高。截至数据统计,总生存期数据尚不成熟。
安全性方面,西达本胺组的3-4级血液学不良事件更常见,包括中性粒细胞减少、血小板减少和白细胞减少症。大多数血液学不良事件都是轻度、可耐受的。