联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
近日,以陈忠文博士(现任复旦大学研究员)和曹宇虹博士(现任国家纳米中心研究员)为共同***作者的一支合作团队在这一方面做出了突破,实现在细胞内同时追踪2~3种不同的蛋白单分子。新方法为观测细胞内蛋白在信号传导中的相互作用提供了更高的时空分辨率。研究论文今日在线发表于《美国国家科学院院刊》(PNAS) 。

这项研究的通讯作者之一、加州大学伯克利分校(UC Berkeley)的纳米材料学家杨培东教授,在先前的工作中开发了一种新型纳米电穿孔(NanoEP)技术,可以***地将生物大分子送入细胞内。在此基础上,此次研究人员利用纳米电穿孔技术,将体外提纯并标记荧光的少量蛋白分子输回细胞内,进行定位和追踪。
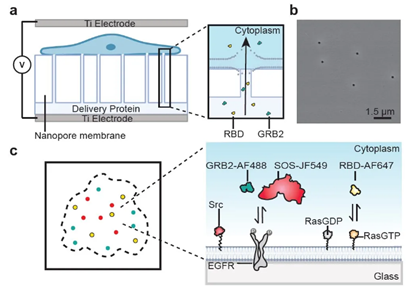
为验证新方法的可行性,研究作者追踪了细胞膜EGFR信号通路中的三种关键蛋白分子Grb2、SOS和 Ras。
研究人员首先验证了,在体外提纯并被荧光标记的Grb2蛋白,通过纳米孔递送进入细胞后,具有与细胞内天然表达的Grb2相似的蛋白活性。他们观察到,在EGFR信号激活以后,细胞质中的Grb2结合到EGFR上并形成半径为160纳米的团簇。多通道单分子追踪发现,SOS会晚于Grb2结合到EGFR上,揭示了EGFR:Grb2:SOS复合体形成的动态过程。而Ras并不会聚集于EGFR周围,提示被SOS激活的Ras会迅速在细胞膜扩散,因而作者提出EGFR受体激活后形成的团簇与Ras引起的下游MAPK信号传导在空间上是分隔开来的。
研究作者还进一步将该技术扩展到了小鼠原代T细胞。原代细胞往往难以转染,实现单分子成像的挑战更大。通过纳米电穿孔,研究作者成功实现了原代T细胞的蛋白递送与荧光成像,且细胞保持很好的活性,极大拓展了该技术的应用范围。