联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
帕金森病影响着全球近千万人的生活。为了破解帕金森病的发病机制,科学家正在努力寻找基因线索,而TMEM175基因就被认为是帕金森病的风险因素。
此前的研究发现,帕金森病患者的TMEM175基因普遍发生了突变。当时的观点是,膜蛋白TMEM175是钾离子进出溶酶体的重要通道。但现在,对于TMEM175在体内的功能,一项发表于《细胞》的研究给出全新的解释。

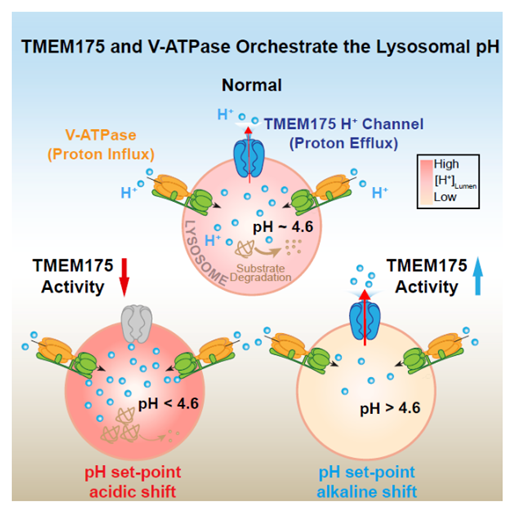
密西根大学徐浩新(Haoxing Xu)教授领导的团队发现,在体内环境中,TMEM175并不扮演钾离子通道,而是质子流出溶酶体的通道,同时是调节溶酶体酸碱平衡的关键因素。这项突破也为帕金森病等神经退行性疾病的机制提供了新的见解。
我们知道,溶酶体是分解蛋白质、核酸、多糖等生物大分子的细胞器。在单层脂蛋白膜的包裹之中,溶酶体内部处于酸性的环境中(pH为4.5~5.0),因而大量酸性水解酶得以在这里发挥作用。而当pH值异常时,溶酶体降解大分子物质的功能受损,可能促进神经退行性疾病的发展。因此,溶酶体pH值的稳态,与神经病理学有着密切的关系。
这种酸性环境是如何形成的?或者说,为什么溶酶体内部可以有更高浓度的质子?此前的研究似乎已经找出了关键:V-ATPase质子泵。这种质子泵可以利用ATP水解供能,将质子逆着电化学梯度泵入溶酶体,维持了溶酶体的正常功能。
不过,这可能还不是完整的答案。V-ATPase质子泵控制质子进入溶酶体,但是否还有其他的“出口通道“控制质子离开溶酶体?下面这项实验告诉我们,答案是肯定的:在抑制了V-ATPase质子泵的功能后,溶酶体内的pH值迅速上升,这说明一定还有某个未知的通道与V-ATPase质子泵互相配合,一进一出,共同调节溶酶体的pH平衡。
▲研究示意图。这项研究揭示了TMEM175如何调控溶酶体的pH值稳定
在***新研究中,研究团队通过筛选将目标锁定在膜蛋白TMEM175上。在筛选实验中,只有当TMEM175过量表达时,明显的质子电流出现了,强度是对照组细胞的约20倍;而在用CRISPR-Cas9技术敲除了TMEM175基因后,电流也随之消失。
根据这些实验结果,膜蛋白TMEM175很可能就是与V-ATPase质子泵协同作用的离子通道。但如果你还记得文章***段的内容,之前的研究告诉我们,TMEM175是溶酶体的钾离子通道。难道说,这个蛋白同时承担了两种离子的运输任务?
很快研究团队找到了问题的关键:环境的酸碱度。之前的研究之所以认为TMEM175是钾离子通道,是因为这些实验忽略了酸碱度对通道的调节作用。而***新研究模拟了溶酶体的酸性环境,这时,TMEM175运送质子的效率是钾离子的近五万倍,这说明TMEM175主要是溶酶体的质子通道而非钾离子通道。
随后的研究揭示了TMEM175的激活机制。一方面,该研究鉴定DCPIB(一种体积调节性阴离子通道的抑制剂)不仅可以在酸性条件下激活氢离子电流,而且在中性条件下同样可以激活钾离子电流。另一方面,研究还发现了TMEM175的内源激活剂:脂质分子花生四烯酸。这说明脂质信号通路很可能对TMEM175的活性起到调节作用。另外,通过巧妙的实验设计,研究者还证实氢离子本身也可以激活TMEM175的氢离子电流。
综上,TMEM175并不是如之前研究认为的是一种自然开放的钾离子通道,而是一种具备门控机制的新型的氢离子通道,其在中性或碱性环境下以及激动剂存在的情况下可以展现出明显的钾离子通透能力。
当研究者通过CRISPR-Cas9技术敲除小鼠的TMEM175基因,膜蛋白TMEM175的缺失导致溶酶体过度酸化,其蛋白水解功能遭到损伤,溶酶体的pH稳态遭到破坏;同时,小鼠神经元中α突触核蛋白也会加速积累——要知道,这种毒性蛋白的堆积是帕金森病的重要标志之一,由此,TMEM175的功能也与帕金森病风险联系在一起。
综上所述,这项研究明确了TMEM175的氢离子通道功能在溶酶体pH调节中的关键作用,并且为我们揭示了其与神经退行性疾病的潜在关联。我们期待,未来的研究能进一步揭开这个关键蛋白在神经退行性疾病中的作用。
RNA提取磁珠属于纳米生物磁珠的一种,主要作用是用于核酸提取过程中的RNA提取,粒径分布在500nm左右,是洛阳吉恩特生物自主研发生产的高分子纳米磁性微球,该磁珠悬浮时间长,磁响应时间迅速,对DNA甲基化过程中的提取环节提供良好的支持,可明显缩短实验时间,提高实验效率,并在提取结果上保持稳定,配合核酸提取仪,更能实现快速的RNA提取。