联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
香港浸会大学蔡宗苇团队与国外团队合作展开的一项研究解释了TCS是如何引发肠道炎症的,这项研究结果揭示了肠道微生物酶对TCS的代谢激活和其肠道毒性的机制,将有助于更好地评估TCS在不同人群中的个体效应。相关研究成果以“Microbial enzymes induce colitis by reactivating triclosan in themouse gastrointestinal tract”为题发表在Nature Communication上。

研究成果(图源:Nature Communication)
在这项研究中,研究人员将特定的肠道微生物酶,尤其是肠道微生物β-葡萄糖醛酸酶 (GUS)与TCS联系起来,并表明这些酶会促进TCS在肠道中造成严重破坏。
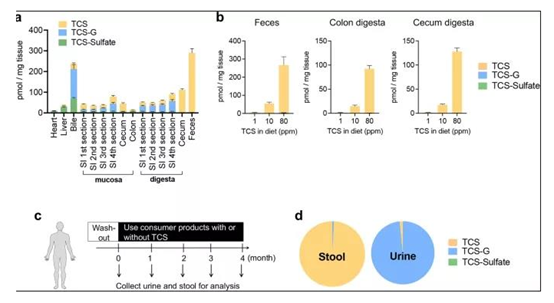
小鼠和人类暴露于TCS之后导致结肠中游离TCS的积累(图源:Nature Communication)
为了确定肠道是否表现出与其他组织不同的TCS代谢特征,研究人员使用TCS在小鼠上进行为期4周的试验,然后使用LC-MS/MS分析小鼠体内各组织中TCS及其代谢物的浓度。他们发现,在暴露于TCS之后,小鼠肝脏、胆汁、心脏和小肠中的TCS代谢物是无生物活性的共轭代谢物TCS-G。而相比之下,小鼠盲肠和结肠得TCS代谢物则以游离TCS为主。这说明,与其他组织相比,在暴露于TCS后,结肠将会存在普遍游离的TCS。
接下来,研究人员进一步在人体中试验,他们分析了暴露于TCS之后受试者体内TCS的代谢特征。LC-MS/MS显示,在所有暴露于TCS的受试者中,粪便样本的主要化合物是游离TCS,尿液样本的主要化合物是TCS-G。粪便中TCS、TCS-G和TCS-sulfate的浓度比为99.2%:0.8%:0,尿液中的这一比例为1.6%:98.4%:0。这些结果表明,人类肠道表现出独特的TCS代谢特征,并且含有高浓度的TCS。
并且,值得一提的是,研究人员发现实验数据显示,从肠道的近端到远端区域,TCS的浓度是增加的,而TCS-G的浓度是不断降低的。因而,他们认为可能存在某种肠道微生物群促进TCS-G转化成TCS。
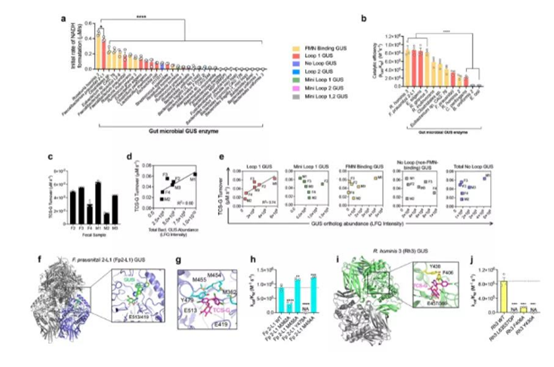
特定的肠道微生物葡萄糖醛酸酶将TCS-G转化为TCS(图源:Nature Communication)
由于肠道β-葡萄糖醛酸酶(GUS)被证明能够将多种葡萄糖醛酸化代谢产物转化为相应的糖基,因此研究人员假设肠道微生物GUS直系同源物会促进TCS-G转化为TCS。***终根据实验结果,他们发现Loop1肠道微生物GUS酶是TCS-G转化为TCS的重要促进物。
在确定了肠道微生物GUS酶能够促进TCS-G转化为TCS之后,研究人员试图通过靶向抑制肠道微生物GUS酶,以减轻甚至是消除TCS在人体内的促结肠炎作用。
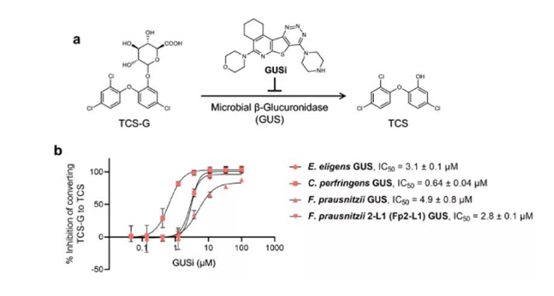
GUSi抑制肠道微生物GUS酶将TCS-G转化为TCS(图源:Nature Communication)
研究人员首先在体外测试了GUS抑制剂GUSi对TCS-G转化过程的影响,发现它通过纯化的Fp2-L1GUS酶以及其他几种Loop1GUS酶抑制了TCS-G向TCS转化。值得注意的是,GUSi也抑制了TCS-G通过FMN结合GUS酶的加工。研究人员又使用GUSi来确定肠道微生物GUS酶在TCS导致结肠炎这一过程中发挥的影响,他们发现暴露于TCS增加了小鼠结肠炎的严重程度,而这一结果被GUSi所消除。因此,肠道微生物GUS酶的抑制消除了TCS的结肠炎促进作用。
RNA提取磁珠属于纳米生物磁珠的一种,主要作用是用于核酸提取过程中的RNA提取,粒径分布在500nm左右,是洛阳吉恩特生物自主研发生产的高分子纳米磁性微球,该磁珠悬浮时间长,磁响应时间迅速,对DNA甲基化过程中的提取环节提供良好的支持,可明显缩短实验时间,提高实验效率,并在提取结果上保持稳定,配合核酸提取仪,更能实现快速的RNA提取。