联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
肠道微生物组 (肠道菌群)是一个极其复杂的微生态系统。近十几年来,通过将微生物组移植到无菌小鼠中的实验不断在这一领域涌出新的研究成果,证实了这些数以万亿计的小生命对宿主健康具有一系列深远影响,包括从肥胖、糖尿病、肠道疾病、癌症、神经发育,以及抑郁症在内的精神类疾病都与它们有关,微生物组甚至还会影响个体对癌症免疫治疗的反应。
然而到目前为止,多种宿主表型的微生物组组成,及其与特定疾病相关的确切细胞和分子机制仍然是个谜。
近日,发表在 《Cell》 上的一项新研究中,来自斯坦福大学微生物组治疗计划(MITI)的研究团队***从头构建了***复杂且定义***明确的合成微生物组,并将其成功移植到小鼠体内,可靠模拟了天然菌群的功能。这一成果为研究肠道微生物组提供了理想的模型,并为开发基于工程微生物组的治疗方法打开了大门。
目前,许多关键的微生物组研究都是利用粪菌移植进行的,即将微生物组从一个生物体引入到另一个生物体。虽然科学家通常会在特定细胞甚至整个小鼠中关闭某个基因或敲除某种蛋白质,但在给定的粪便样本中,还没有一种工具可以实现在数百种细菌中操纵其中的一种。
在这项新研究中,研究人员提出一个解决方案:通过单独培养细菌然后与其他细菌混合的方法,从头合成微生物组。 微生物组中的每一个细胞都占据一个特定的功能生态位,执行分解和构建分子的反应。 此外,还必须要确保***终的合成微生物组不仅稳定、保持稳态(不能出现压倒性菌种),而且还要具有功能性,能够执行天然微生物组的所有行为。
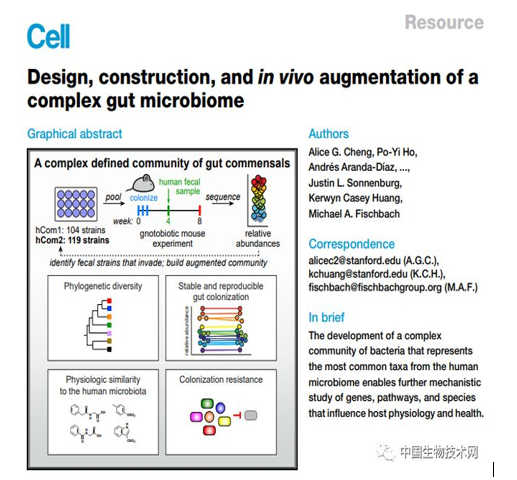
他们选择了大约20%的人类微生物组计划受试者中存在的细菌菌株,然后在体外构建并表征了一个由104种细菌组成的特定菌群,他们称其为hCom1。
虽然这些细菌菌株可以在培养皿中共存,但真正的考验是“人工菌群”能否在肠道中定植。接下来,研究人员将hCom1引入精心设计的无菌小鼠体内。
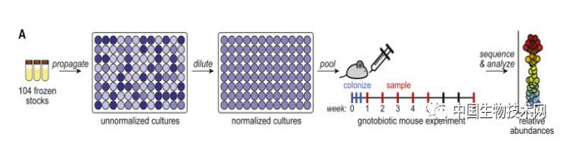
结果令人满意,98%的菌种定植在无菌小鼠的肠道中,hCom1非常稳定,每个菌群的相对丰度水平在两个月内保持不变。
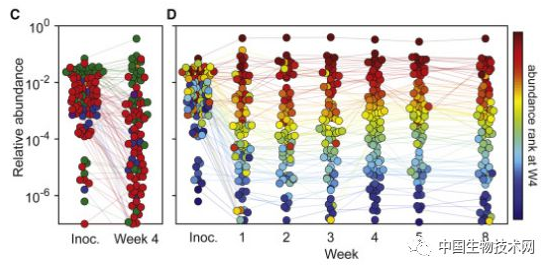
为了使人工菌群更加完整,并确保所有重要的微生物组功能都能由一种或多种细菌来完成。他们借鉴了“定植抗性”理论——任何被引入现有菌群的细菌,只有在能填补尚未占据的生态位时才能存活。
结果显示, 在被粪便样本挑战的小鼠中,第8周平均89%的基因组副本来自hCom1, 其余11%代表了从粪便样本中加入到hCom1的新菌种。 尽管有新菌种加入,hCom1的菌群结构仍然保持不变。 因此,hCom1对人类粪便的挑战具有广泛但不完全的弹性。
生物磁珠对细胞筛选的方法已日渐成熟,原理是将包被一抗的磁珠与细胞表面对应的分子特异性结合,或者将包被二抗的磁珠与已经与细胞表面分子特异性结合的一抗结合。磁珠携带与之结合的细胞吸附与分离柱或试管上,实现阳性细胞或阴性细胞的分离。洛阳吉恩特生物自主研发生产了各类生物磁珠,可以实现稳定的实验结果。