联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
***了解基因调控网络(GRN)控制细胞状态是分子生物学的基本目标。转录因子(Transcription factors,TF)结合到基因组中的特定序列,以改变基因表达和特定细胞的状态。单个转录因子的过表达就足以导致细胞命运的深刻变化,例如,改变转录因子的表达可以诱导多能干细胞向特定类型细胞的再分化。而多个转录因子组合的过表达可以在基因调控网络中产生更大的变化,例如,过表达四个转录因子(Oct4、Sox2、Klf4和c-Myc)就能将成熟细胞重编程为多能干细胞。
这些发现强调了转录因子驱动细胞状态变化的力量,也强调了转录因子的过表达在理解调控细胞命运的基因表达程序方面的效用。
人类基因组中有超过1800个转录因子基因位点,它们编码了超过3500个转录因子异构亚型,这创造了一个巨大的基因调控景观。然而,之前对于这一景观的研究,要么只能实现筛选广度,要么只能实现读出深度。要想完全破译转录因子调控回路,需要一种系统性方法,既能综合筛选广度,又能实现读出深度,尤其是每个转录因子诱导的转录组变化。
近日,张锋实验室在 Cell 期刊发表了题为:A transcription factor atlas of directed differentiation 的研究论文。
该研究创建了一个涵盖了人类所有转录因子异构亚型(共3548个)的条形码文库,并将其用于构建转录因子图谱(TF Atlas),以单细胞分辨率绘制了每个转录因子过表达在人类胚胎干细胞(hESCs)中引起的表达谱变化。
这个***的转录因子图谱既可以系统地识别驱动细胞状态变化的转录因子,也可以对孤儿转录因子进行分类等研究,还可以用来预测和验证不同转录因子组合对细胞的影响。

转录因子通过调控基因程序,从而控制不同的细胞过程和细胞状态。想实现对转录因子的过表达有两种方法,分别是通过CRISPRa来激活内源转录因子表达,以及直接过表达转录因子的开放阅读框(ORF)。张锋团队在人胚胎干细胞(hESCs)验证了这两种不同的过表达方法的效果,结果显示,直接过表达NEUROD1或NEUROG2的ORF可以诱导hESCs分化为神经元,而CRISPRa则不行,这可能是因为hESCs中存在着转录后调控机制,能够缓冲蛋白质过表达,因此,研究团队决定使用过表达转录因子ORF的方式进行后续研究。
为了***了解转录因子及其调控程序,张锋团队创建了一个人类转录因子条形码文库,该文库由1836个基因编码的3548个转录因子异构亚型组成,涵盖了人类所有的转录因子异构亚型。每个亚型都与一个独特的条形码相关联,便于转录因子的识别。
为了构建所有转录因子过表达效应的转录因子图谱(TF Atlas),研究团队将上述转录因子条形码文库转导到人胚胎干细胞(hESCs)中,并在STEMdiff APEL培养基中培养7天,然后对细胞进行单细胞RNA测序(scRNA-seq),获得了110万个单细胞RNA测序结果,从而以单细胞分辨率绘制了过表达每个转录因子的人类胚胎干细胞(hESCs)的表达谱。这些结果表明,通过scRNA-seq分析转录因子效应的方法***大限度地扩大了转录因子诱导细胞状态的可能范围,并为详细描述转录因子过表达的影响奠定了基础。
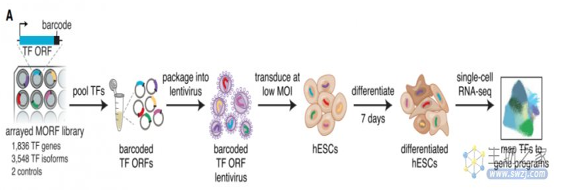
接下来,研究团队将转录因子诱导的表达谱映射到参考细胞类型,并验证候选转录因子用于生成不同的细胞类型,涵盖所有三个胚层和滋养层细胞。基于这一转录因子图谱,研究团队还能用于创建定制的细胞疾病模型,并整合mRNA表达和染色体可及性数据,已识别下游调控因子。更重要的是,该转录因子图谱还可以用来预测不同转录因子组合对细胞的影响,从而加速细胞工程研究。
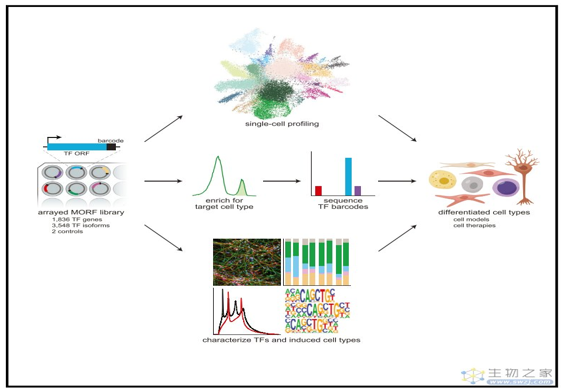
总的来说,该研究创建了一个***的人类转录因子条形码文库和转录因子图谱,并用该图谱绘制了转录因子过表达在人类胚胎干细胞(hESCs)中引起的表达谱变化。这个***的转录因子图谱既可以系统地识别驱动细胞状态变化的转录因子,构建人类细胞疾病模型,也可以对孤儿转录因子进行分类等研究,还可以用来预测和验证不同转录因子组合对细胞的影响。
DNA提取磁珠可以有效的从标本中提取基因组DNA、病毒DNA或游离DNA,采用化学合成的方法将四氧化三铁进行特殊的处理,使其粒径达到均一化分散,再通过特殊的材料进行官能基团(如硅羟基、羧基)的包覆。包覆官能基团后,磁珠具备了核酸吸附能力,配合核酸提取仪,可以自动化的提取DNA和RNA。