联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
宿主细胞依赖多种免疫应答机制来对抗病毒感染。其中,针对核酸分子的免疫识别和操作是核心的抗病毒免疫策略,广泛存在于从细菌到哺乳动物等几乎所有宿主系统(图1)。相较于哺乳动物细胞稍显复杂的信号转导和调控,细菌往往更为简单***,其编码的多种抗病毒免疫系统可直接对核酸分子进行切割或修饰(图1)。这种特点使得细菌免疫系统被广泛用于多种生物学工具的开发(如R-M和CRISPR-Cas等),促进整个生命医学领域的发展。
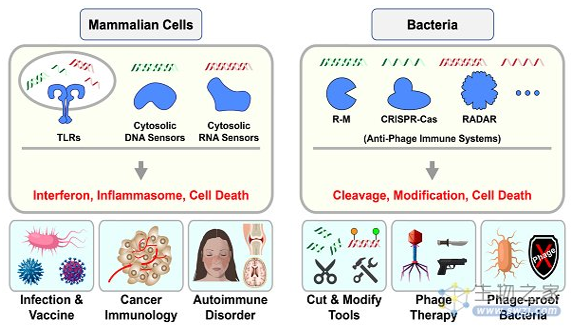
图1.针对核酸分子的免疫识别和操作
近期,张锋和Eugene Koonin团队鉴定出拥有全新核酸修饰活性的细菌免疫系统——RADAR(phage restriction by an adenosine deaminase acting on RNA)。RADAR是目前已知***可通过催化RNA的A-to-I(adenosine-to-inosine)脱氨来执行抗病毒功能的细菌防御系统,包含两种核心组分即RdrA(ATPase酶活性)和RdrB(腺苷脱氨酶活性),且这两种酶活性对于RADAR执行功能都是必须的。病毒感染后,RADAR被激活并广泛催化宿主及病毒的转录组RNA脱氨,造成被感染细胞的死亡,进而阻断病毒传播。RADAR在抗病毒免疫和RNA修饰方面展现出多种新颖特点,且有潜力被开发为新型的生物学工具,因此受到领域内的广泛关注。当前,关于RADAR的研究仅是冰山一角,还有较多核心科学问题亟待回答。
中国科学院生物物理研究所高璞团队在 Cell 期刊发表了题为:Molecular basis of RADAR anti-phage supramolecular assemblies 的研究论文。
该研究发现了RADAR不同组分间的互作关系,揭示了其通过形成新型超分子复合体来实现RNA装载、运输和脱氨修饰的精妙偶联机制,拓展了科学家对细菌-病毒博弈复杂性的认知,并为开发基于RADAR的多种生物学工具提供了思路。

此前已知能催化RNA A-to-I 脱氨的酶只有ADAR和ADAT两类,从进化上均属CDA超家族。而RADAR中的脱氨酶组分RdrB,在进化上却属于差别巨大的ADA超家族。RdrB的大小近3倍于经典ADA成员,除催化结构域外还存在多个作用未知的插入区域。为更好地剖析RdrB的功能,研究人员解析了RdrB的高分辨率冷冻电镜结构,发现了12个RdrB按照特定方式组装成一个闭合的笼状结构(~1.1MDa)。该笼状结构拥有典型的正六面体排列,这在ADA和CDA超家族中均未被报道。这种精巧的组装依赖于催化结构域和多个插入区域的协同作用。进一步的功能实验表明,RdrB亚基间的互作对抗病毒功能至关重要。所有RdrB的催化口袋都朝向笼子的外侧,暗示其随时准备识别和催化临近的底物。
研究通过结构分析和生化验证发现,RdrB并不能有效结合含Stem-Loop元件的底物RNA。那么,对RADAR功能同样关键的另一个组分RdrA,是否会协助RdrB对RNA的修饰?科研人员解析了RdrA的结构发现,RdrA同时组装成单层的7聚体环(~0.75 MDa)和由两个7聚体环叠合而成的双层14聚体环(~1.5 MDa)。每个7聚体环都呈现为顶部结构稳定、而底部结构动态多变的特点,提示这两个区域潜在的不同功能。更重要的是,RdrA环中心形成了一个独特的通道,其直径和表面电荷均符合底物RNA的特点,提示该通道可能用于底物运输。后续生化实验表明,RdrA环与Stem-Loop RNA存在特异性结合,且RNA的存在可显著促进RdrA的ATPase酶活性。接下来,研究人员解析了RdrA与Stem-Loop RNA复合物的结构,捕捉到RNA装载到RdrA环的动态底部的构象。同时,研究发现RNA的装载与ATP的结合存在联动关系,提示RdrA可通过控制ATP水解来发挥其底物的装载和运输功能。
核酸提取磁珠作为新冠病毒RNA提取的重要原料,是吉恩特生物自主研发生产的高分子材料,将均一的分子材料的粒径控制在合理的范围内,加入磁性,再引入配基,从而使分子材料具备磁响应性和生物吸附性能,在核酸提取的过程中可以得到良好的应用,尤其是GNT-108磁珠,更是对新冠病毒的RNA提取具有较高的特异性,提取结果可直接应用与下游定量检测。