联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
在出生后不久,我们心脏的心肌细胞(Cardiomyocytes,CMs)的能量代谢从糖酵解转向氧化代谢,导致线粒体稳态、细胞结构和电生理特性等方面的重大重排。作为成熟程序的一部分,大多数心肌细胞在出生后早期终止细胞周期,并经历肥大性生长,同时发生细胞-细胞和细胞-细胞外基质相互作用的变化。由于高代谢活性,心肌细胞的出生后成熟伴随着氧化DNA损伤,这也为心肌细胞的***创造了天然屏障。
因此,人类在一出生后,心脏就几乎完全丧失了再生能力。一旦发生心肌损伤,就会导致心脏功能的***性丧失。
而***近,来自马克斯·普朗克心肺研究所的华人学者***证明,心肌细胞能量代谢的改变能够使心脏再生。这项开创性科学突破,有望为心肌梗死等心脏病带来全新治疗方法。
这项重磅科学突破,近日以:Inhibition of fatty acid oxidation enables heart regeneration in adult mice 为题,发表于国际***学术期刊 Nature,论文通讯作者为德国马克斯·普朗克心肺研究所的袁学军研究员和Thomas Braun教授,***作者为 Li Xiang博士。

成年人心脏再生能力的丧失,主要是由于出生后心肌细胞***能力的丧失。这伴随着心肌细胞能量代谢的根本变化——心肌细胞不再从糖中获取能量(糖酵解),而是转变成主要从脂肪中获取能量(脂肪酸氧化)。这是因为脂肪酸氧化这种氧化代谢方式产生能量的效率更高。
而心脏能够再生的动物主要通过糖酵解方式将糖类作为心肌细胞的“燃料”。实际上,人类心脏在发育早期阶段也是主要使用糖酵解,只是在出生后转向脂肪酸氧化。随着出生后心脏的能量代谢方式的转换,心肌细胞的许多基因的活性发生了变化,其细胞***活性也消失了。能量产生过程中的代谢物对调节基因活动的酶的活性发挥着重要作用。
论文共同通讯作者袁学军表示,这种缺血-再灌注损伤模型可以与因冠状动脉闭塞而心脏被放置支架的心脏病人相比较。而Cpt1b基因失活的效果令人印象深刻——心肌梗死后常见的疤痕在几周后几乎消失,小鼠的心肌收缩能力也几乎恢复到了梗死前的水平。
研究团队进一步破译了这种再生能力背后的机制,在Cpt1b基因失活的小鼠心肌细胞中,研究团队发现α-酮戊二酸(α-ketoglutarate,简称α-KG)的水平增加了20倍,这种高水平的代谢物导致KDM5酶活性的显著增加。KDM5是一种组蛋白去甲基化酶,激活的KDM5使得驱动心肌细胞成熟的基因中的广泛H3K4me3结构域的去甲基化,恢复这些基因的活性和表达。这些基因活动的变化导致心肌细胞变得不成熟,从而重新获得再生能力。
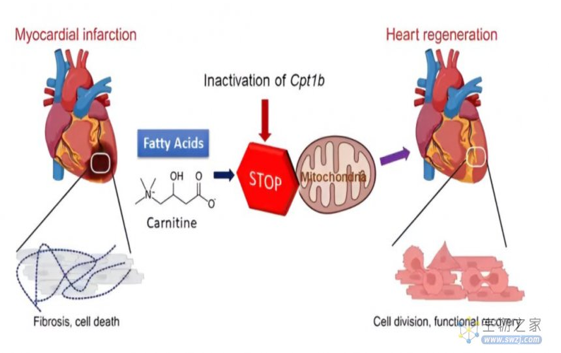
基于上述结果,研究团队得出结论——代谢成熟塑造了心肌细胞的表观遗传景观,为进一步的细胞***创造了障碍,而逆转这一过程可以让恢复心肌细胞的再生能力,进而修复受损的心脏。
生物磁珠对细胞筛选的方法已日渐成熟,原理是将包被一抗的磁珠与细胞表面对应的分子特异性结合,或者将包被二抗的磁珠与已经与细胞表面分子特异性结合的一抗结合。磁珠携带与之结合的细胞吸附与分离柱或试管上,实现阳性细胞或阴性细胞的分离。洛阳吉恩特生物自主研发生产了各类生物磁珠,可以实现稳定的实验结果。