联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
随着第三代基因编辑技术——CRISPR/Cas9技术斩获2020年诺贝尔化学奖,“基因编辑”一词便频繁地出现在大众视野中。然而,这把基因的“手术刀”只有被送到靶细胞才能发挥其特定作用,因此,在体内精准递送基因编辑系统仍然是该技术应用于医药学领域的重大挑战之一。
基因编辑工具只有被递送到靶点部位才能真正发挥作用,其在应用于疾病治疗时主要有两种递送形式:一是从患者体内提取需要改造的细胞,在体外用基因编辑技术进行工程化改造后,再回输至患者体内;二是通过各种形式的制剂实现基因编辑系统在体内的递送,把基因“手术刀”递送至靶组织或靶细胞中进行治疗。
然而,在递送过程中存在诸多挑战。首先,为了防止不良反应的产生,需要把基因编辑工具准确递送体到内的特定部位。笔者团队曾在2021年开发了一种具有炎症靶向性的基因编辑前药系统[3],选用一种受小分子调控的Cas9变体,并将这种小分子设计成只有在炎症环境中才能被激活的前药,从而减少了基因编辑治疗过程中的组织脱靶问题。其次,基因编辑工具通过细胞膜进入细胞并非易事。对于CRISPR/Cas系统而言,递送主要分为gRNA的递送和Cas蛋白的递送。其中,gRNA可以直接以RNA形式递送,或通过质粒DNA形式递送到体内后再完成转录;而Cas蛋白有3种递送形式:递送对应的质粒DNA、mRNA或直接递送蛋白。这些生物大分子由于尺寸问题和特殊的荷电性质,往往需要特定的载体或物理方法来介导进入细胞[4],如使用病毒载体和非病毒载体、采用显微注射、电穿孔、基于微流控的技术等物理方法等[5]。
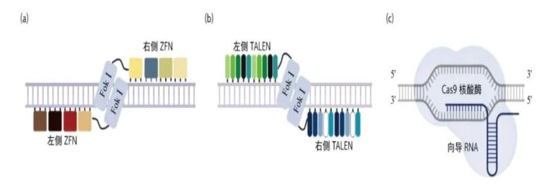
3代基因编辑工具 (a)ZFN基因编辑技术;(b)TALEN基因编辑技术;(c)CRISPR/Cas9基因编辑技术系统。
病毒基因编辑递送系统
病毒系统是相对来说比较成熟的基因编辑递送系统,常用的载体有整合酶缺陷型慢病毒载体、腺相关病毒载体和腺病毒载体。
整合酶缺陷型慢病毒载体
整合酶缺陷型慢病毒载体由慢病毒改造而来,由于整合酶缺陷而无法将目的基因整合入宿主的基因组中,具有一定的安全性。这类系统可被用于递送ZFN基因编辑工具。在体外,整合酶缺陷型慢病毒可通过递送ZFN基因编辑工具的mRNA和供体DNA模板,在各种细胞中实现基因编辑。然而在某些细胞系内,该系统的编辑效率并不高,同时,其基因编辑效果会随着靶点细胞的***而逐渐减弱[2]。
腺相关病毒载体
腺相关病毒载体是一种含有单链线状DNA的小型无包膜病毒,其基因组中包含两个反向末端重复序列,通常需要在辅助病毒的帮助下才能发挥作用。而重组腺相关病毒从野生型腺相关病毒改造而来,传递基因时不需要辅助病毒,已被广泛用于基因编辑系统的体内和体外递送。有研究表明,在某些情况下,用腺相关病毒载体递送基因编辑工具的效率高于整合酶缺陷型慢病毒载体[2],且递送CRISPR基因编辑工具时可以实现持久的编辑[6]。然而,这类编辑系统的应用也存在一系列的挑战,如重组腺相关病毒载体所能荷载的基因组大小有限,仅5.0 kb左右,使用时需要控制“货物”的大小;同时,它的持久编辑功能可能导致CRISPR/Cas工具过表达,造成脱靶效应;此外,还可能会带来免疫原性问题,引发一些免疫毒性[6]。
腺病毒载体
腺病毒载体是一种含双链DNA的病毒,由于感染能力较强、基因不整合到宿主细胞等优点,是目前临床上***常用的基因治疗病毒载体。***项用于人体的基因编辑临床试验就是利用的腺病毒载体递送系统。CCR5是存在于T细胞表面的一种可以协助HIV病毒入侵的受体,在体外用携带ZFN基因编辑工具的载体系统敲除CCR5基因后,产生不会被HIV感染的T细胞。自体移植后,抗HIV小分子药物治疗中断后,CCR5敲除的T细胞比正常T细胞存活得更好[7]。
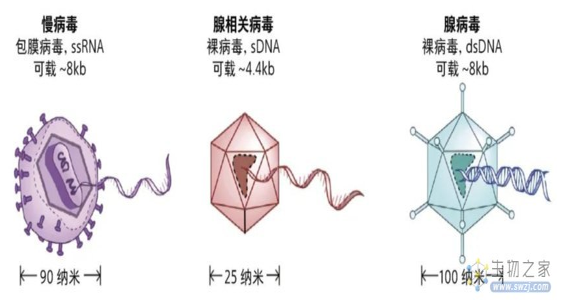
3种病毒载体[7]
非病毒基因编辑递送系统
非病毒介导的基因编辑递送系统尽管基因组编辑酶的效率不如病毒递送方法,但其核酸酶活性具有瞬时优势。更重要的是,与病毒载体不同,非病毒载体可以重复给药,从而提高基因编辑成功的机会。
物理递送方法
通过物理方法破坏细胞膜或使之变形,将基因编辑工具递送到细胞内,常用的物理递送方法有显微注射、电穿孔、微流控等。
显微注射是转染效率极高的一种递送方法,且递送的“货物”大小不受***,常用于递送核酸类大分子,如用微米级别的针头穿破细胞膜,将可以编码CRISPR/Cas工具的质粒DNA直接注射到细胞中。该方法还可以用于递送mRNA等,从而在胞内表达基因编辑工具[5]。
同显微注射一样,电穿孔也是较为成熟的物理递送方法,通过电场作用增加细胞膜的通透性,从而介导DNA、核糖核蛋白复合物等生物大分子进入。研究显示,与DNA相比,电穿孔方法导入核糖核蛋白复合物时具有更高的效率,且不易形成脱靶。但由于在体内难以控制电穿孔需要的各种参数,该技术目前多被用于体外基因编辑。
生物磁珠对细胞筛选的方法已日渐成熟,原理是将包被一抗的磁珠与细胞表面对应的分子特异性结合,或者将包被二抗的磁珠与已经与细胞表面分子特异性结合的一抗结合。磁珠携带与之结合的细胞吸附与分离柱或试管上,实现阳性细胞或阴性细胞的分离。洛阳吉恩特生物自主研发生产了各类生物磁珠,可以实现稳定的实验结果。