联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
尽管脊髓对于人体的各种生命活动至关重要,但我们对于脊髓衰老的机制仍知之甚少。哪些生物标志物能够指征脊髓衰老?脊髓衰老的驱动力是什么?能否开发出干预脊髓衰老的手段?一系列关键科学问题亟待解答。中国科学院动物研究所刘光慧课题组联合中国科学院北京基因组研究所张维绮课题组、中国科学院动物研究所曲静课题组合作,在国际***学术期刊 Nature 上发表了题为:CHIT1-positive microglia drive motor neuron aging in the primate spinal cord 的研究论文。
该研究历时7年,通过综合运用单细胞核转录组、神经组织学、神经电生理等技术手段,发现了一群全新的在年老的灵长类动物的脊髓中特异存在的CHIT1阳性小胶质细胞亚型,并将其命名为——AIMoN-CPM(Aging-Induced Motor Neuron toxic CHIT1-Positive Microglia),这类细胞可以通过旁分泌CHIT1蛋白激活运动神经元中的SMAD信号,进而驱动运动神经元衰老,而补充维生素C可抑制脊髓运动神经元的衰老和退行。

非人灵长类食蟹猴同人类的神经系统极为相似,尤其在两足行走和精细运动控制方面。因此,以食蟹猴作为研究模型,在理解人类自身的神经系统功能及干预神经退行性疾病方面具有特殊的优势。
研究团队首先通过人工智能(AI)辅助的方式,发现年老猴的运动能力与年轻个体相比显著降低。进而借助神经组织学分析手段,研究团队证实运动神经元是脊髓中对衰老***为敏感的细胞类型,具体表现为细胞衰老相关标志物显著增加以及神经元功能的退行。
为进一步揭示运动神经元老化的原因,研究团队绘制了一张详细的食蟹猴衰老脊髓单细胞转录组导航图。按图索骥,寻找到了驱动运动神经元衰老的罪魁祸首,即一群在老年灵长类脊髓中特异性积累的CHIT1高表达的激活型小胶质细胞(AIMoN-CPM)。通过组织病理学、细胞生物学和分子生物学分析,研究团队发现AIMoN-CPM倾向于聚集在衰老的运动神经元周围,并通过旁分泌CHIT1蛋白激活周边运动神经元中的SMAD信号,进而驱动后者的衰老和退行(图2)。
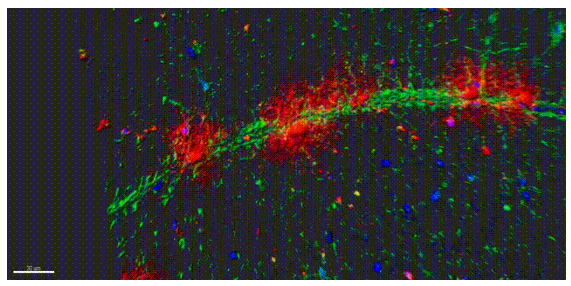
图2:衰老灵长类脊髓中AIMoN-CPM小胶质细胞(红色)在运动神经元轴突(绿色)处聚集
进一步研究发现,CHIT1含量在老年人和猴的脑脊液和血清中均显著升高,提示CHIT1可以作为度量灵长类脊髓年龄的体液标志物。而利用手术机器人将CHIT1注射到猴的脑脊液中可以触发脊髓运动神经元衰老及轴突传导功能障碍,进而损伤机体运动能力。接下来,研究团队建立了人类运动神经元与微环境的体外互作模型,并利用该模型揭示老年个体的脑脊液能以CHIT1依赖的方式诱导人类运动神经元衰老。靶向CHIT1的中和抗体可以有效阻断老年脑脊液的促神经元衰老活性,显示出CHIT1作为靶点应用于延缓运动神经元衰老的潜力。
更为重要的是,研究团队基于人类运动神经元与微环境的体外互作模型进行药物筛选时,发现维生素C能有效抑制CHIT1诱导的运动神经元衰老。进一步,非人灵长类体内实验表明,三年维生素C的口服用药可以明显改善老年食蟹猴脊髓运动神经元的衰老表型(图3)。
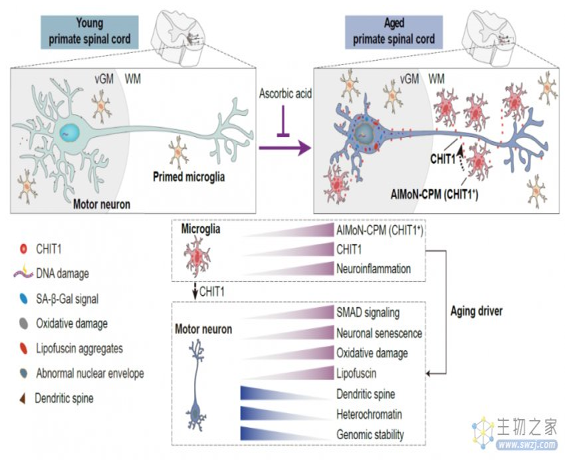
图3. 灵长类脊髓衰老全景图
综上,该研究***系统刻画了灵长类脊髓衰老的表型、病理及细胞分子特征,并揭示了一种可促进运动神经元衰老的新型小胶质细胞AIMoN-CPM。CHIT1不仅介导了AIMoN-CPM对运动神经元的毒性作用,而且可以作为一种度量人类脊髓衰老程度的体液标志物。更为重要的是,该研究创新性地建立了人类运动神经元-微环境互作研究体系,为开展人类神经系统衰老研究及相关的药物评价提供了新范式。鉴于脊髓运动神经元对于遍布全身的包括骨骼肌、平滑肌和心肌在内的肌肉系统的指挥调控作用,加深对灵长类脊髓衰老机制的认识无疑会深化学术界对人类多种器官退变规律的理解。AIMoN-CPM和CHIT1的发现,为理解脊髓衰老及老年群体多种慢病共存开辟了新的科学疆域,以AIMoN-CPM和CHIT1为靶标,或可为延缓人类脊髓衰老、实现老年共病的积极防控带来新的希望。
ctDNA的提取在肿瘤筛查中,是重要的前置步骤。目前常用的提取方法是利用生物磁珠,主要是硅羟基磁珠或羧基磁珠对血清血浆的ctDNA进行提取,由于磁珠的粒径小,比表面积大,在特定提取缓冲液中,对核酸的吸附会更加灵敏,相比于其他方法,使用生物磁珠对进行ctDNA提取得率会更高,检测灵敏度和检出限也会更合适,搭配核酸提取仪,更能实现全程自动化的提取。