联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
DNA是一种相对稳定的有机分子,但仍然会受到来自各种外源性压力(例如紫外线照射、电离辐射和化学暴露)以及内源性因素(例如复制错误、细胞代谢和氧化应激)的不断攻击,***终会导致单链DNA断裂(SSB)或双链DNA断裂(DSB)。因此,细胞进化出了一个复杂的生化途径系统来处理这种威胁,统称为DNA损伤应答(DNA-damage response,简称DDR),以防止有害的突变被继续传递。
“合成致死”的概念用于描述两个功能性基因同时失活导致细胞死亡的现象,随着PARP抑制剂的成功,“合成致死”领域引起大家广泛的关注。在伴有DDR某条通路缺陷的肿瘤细胞中,DNA修复将高度依赖于其他旁路途径,而若此时这些通路被药物再次抑制则会产生“合成致死”效应。利用这一效应,DDR成为抗肿瘤药物的研发靶点。 
DDR通路
DDR是生物的基本生理机制之一,这一机制旨在保护生物的基因组。2015年9月8日,DNA损伤应答发现者因此获得2015年拉斯克奖基础医学研究奖。DNA损伤应答机制重要而复杂,主要通过两种手段,即DNA损伤修复和细胞凋亡,来保护其正常的生理功能和稳定的遗传性状(图1)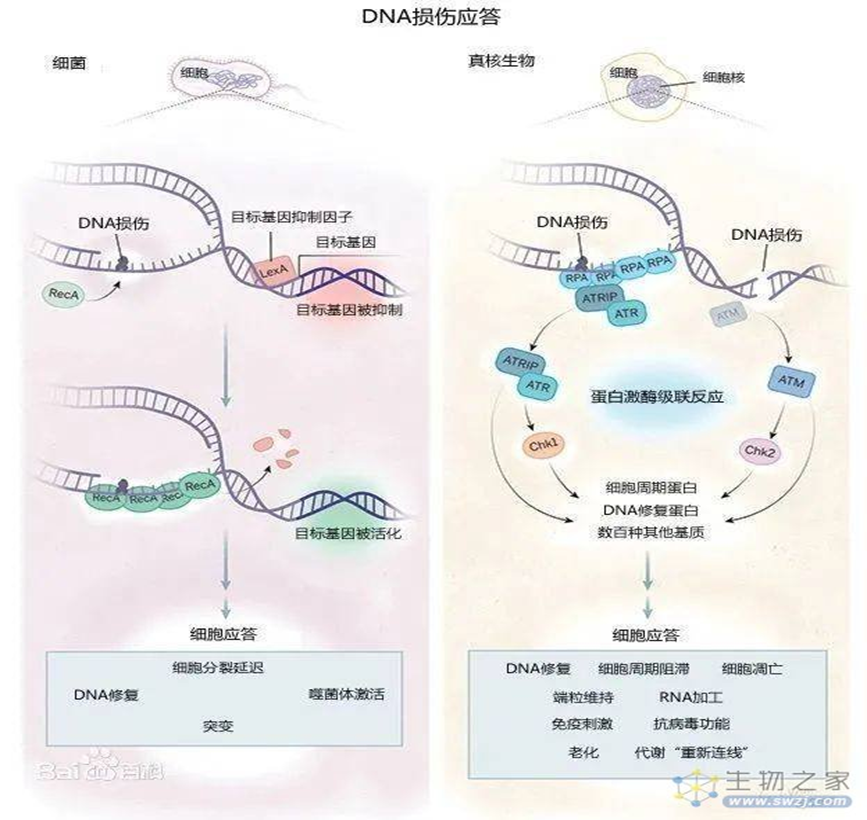
图1. DNA损伤应答,图源:百度百科
DNA损伤修复有非同源末端连接(NHEJ),同源重组(HR),错配修复(MMR),核苷酸切除(NER)等,识别DNA损伤和尝试修复DNA[1]。如果修复成功,细胞恢复复制;否则,就会触发细胞程序性死亡或衰老机制。双链DNA断裂(DSB)可以通过两种主要机制进行修复:BRCA1/2介导的同源重组(HR)和典型 DNA-PKcs介导的非同源末端连接(c-NHEJ)。
HR被认为是一种准确的DSB修复途径,因为它依赖于细胞周期S/G2期细胞的姐妹染色单体作为DNA合成和DSB修复的模板。因此,HR能够修复DSB,主要在增殖细胞中。DDR过程中涉及很多激酶,如RAD51,ATM,ATR,CHK1,WEE1,PKMYT1和DNA-PK等,它们的异常与很多疾病相关,它们也是合成致死领域研究的热门靶点。
临床靶向DDR激酶治疗有ATM抑制剂,DNA-PK抑制剂,ATR抑制剂,CHK1抑制剂,WEE1和PKMYT1抑制剂等,除此之外,还有一些新兴的疗法和新的靶点选择,如POLQ抑制剂针对HR缺乏的肿瘤,USP1抑制剂针对BRCA1/2缺失的癌症,RAD51抑制剂和靶向于微卫星不稳定性癌症中的解旋酶WRN等。本文主要介绍一下DDR通路相关激酶ATR,ATM,DNA-PK,CHK1,WEE1和POLQ抑制剂。
DNA提取磁珠可以有效的从标本中提取基因组DNA、病毒DNA或游离DNA,采用化学合成的方法将四氧化三铁进行特殊的处理,使其粒径达到均一化分散,再通过特殊的材料进行官能基团(如硅羟基、羧基)的包覆。包覆官能基团后,磁珠具备了核酸吸附能力,配合核酸提取仪,可以自动化的提取DNA和RNA。