联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
CRISPR(Clustered regularly interspaced short palindromic repeats)是生命进化历史上,细菌和病毒进行斗争产生的免疫武器,简单说就是病毒能把自己的基因整合到细菌,利用细菌的细胞工具为自己的基因复***务,细菌为了将病毒的外来入侵基因清除,进化出CRISPR系统,利用这个系统,细菌可以不动声色地把病毒基因从自己的染色体上切除,这是细菌特有的免疫系统。微生物学家10年前就掌握了细菌拥有多种切除外来病毒基因的免疫功能,其中比较典型的模式是依靠一个复合物,该复合物能在一段RNA指导下,定向寻找目标DNA序列,然后将该序列进行切除。许多细菌免疫复合物都相对复杂,其中科学家掌握了对一种蛋白Cas9的操作技术,并先后对多种目标细胞DNA进行切除。这种技术被称为CRISPR/Cas9基因编辑系统,迅速成为生命科学***热门的技术。
被誉为“世纪发现”的基因编辑工具CRISPR革新了生物医学研究,并为多种疾病的治疗带来了新的希望。近日,发表在Nature Medicine上的2篇论文却给这一“魔剪”泼了盆冷水!研究称,使用CRISPR-Cas9可能会带来意想不到的后果——增加癌症风险!成果一经发表就引发了热议,同时还使相关公司的股价大跌!
论文一
在题为“CRISPR–Cas9 genome editing induces a p53-mediated DNA damage response”的论文中,由瑞典Karolinska研究所的Jussi Taipale教授带领的团队发现,CRISPR-Cas9触发了一种保护细胞免受DNA损伤的机制,这使得基因编辑变得更加困难。而与正常细胞相比,缺乏这种保护机制的细胞则更容易被编辑。

图片来源:Nature Medicine(doi:10.1038/s41591-018-0049-z)
“我们发现,用CRISPR-Cas9编辑细胞的基因组会诱导一种名为p53的蛋白质的激活。该蛋白就像细胞的‘报警系统’,会发出DNA受损的信号,并打开修复DNA损伤的‘急救箱’。正是这一系统的启动使得编辑健康细胞的基因组变得更加困难。”论文的共同***作者Emma Haapaniemi博士解释道
这一发现是令人担忧的。因为,健康细胞中p53会修复CRISPR编辑或杀死被编辑的细胞的“对立面”是,如果一个细胞的基因组成功被CRISPR编辑了,且细胞也存活了下来,这意味着,该细胞的p53是功能不全的,缺乏健康细胞中那种“要么修复、要么杀死”的机制(fix-it-or-kill-it mechanism)。随之而来的问题是,p53功能障碍能够导致癌症发生。一组可怕的数据是:p53突变导致了近一半的卵巢癌、43%的结直肠癌、38%的肺癌、近三分之一的胰腺癌、胃癌和肝癌以及四分之一的乳腺癌。
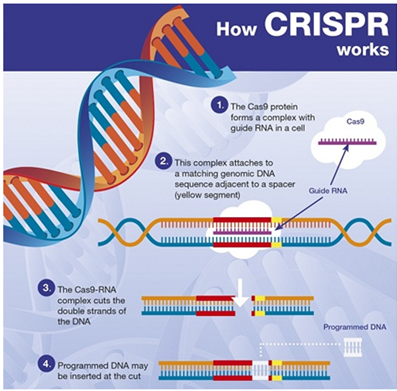
当前,利用CRISPR-Cas9技术的研究人员首先需要构建一个sgRNA(single-guide RNA)。sgRNA中包含一段与目标DNA匹配的序列,被附着在Cas9酶上。将Cas9-sgRNA复合物引入到目标细胞后,sgRNA会找到与其匹配的DNA序列,然后,Cas9酶结合目标DNA序列,切断双链。(图片来源:网络)
在该研究中,科学家们还证实,通过降低细胞中p53的活性,他们能够更加有效地编辑健康细胞。然而,尽管这种方法可能会降低CRISPR选择p53缺陷细胞(p53-deficient cells)的风险,但也可能会使被编辑的健康细胞容易受到致癌突变的影响。
Taipale教授说:“CRISPR-Cas9是一种用于科学研究以及开发挽救生命的医学疗法的非常有前途的生物学工具。我们并不想‘危言耸听’,也不是说CRISPR-Cas9就是坏的、危险的,但依据目前的发展趋势,该技术显然将成为医学领域的主要工具,因此,关注其潜在的安全问题是非常重要的。就像任何其他疗法一样,总会有副作用或潜在的危害,我们需要做的是,平衡治疗的危害与益处。”
“虽然我们还不了解p53激活背后的机制,但我们认为,研究人员在开发新疗法时需要意识到潜在的风险。这就是为什么当我们一发现经CRISPR-Cas9编辑的细胞可能会癌变时,就立刻决定公布我们的研究结果。”他补充道。

图片来源:Nature Medicine(doi:10.1038/s41591-018-0050-6)
论文二
无独有偶,在题为“p53 inhibits CRISPR–Cas9 engineering in human pluripotent stem cells”的另一篇论文中,来自诺华生物医学研究所的科学家们也获得了类似的结果。据他们估计,在多能干细胞中,p53使CRISPR的效率降低了17倍。
事实上,该研究***初的目的是,提高CRISPR编辑多能干细胞(这种干细胞几乎可以转变为任何类型的细胞,从而可能用于多种疾病的治疗)的效率。实验中,领导该研究的神经科学家Ajamete Kaykas使CRISPR插入或删除DN***段的效率达到了80%。但不幸的是,当CRISPR起作用时,正是因为p53没有起作用。
这意味着,被CRISPR-Cas9成功编辑的细胞有可能会在患者体内埋下“肿瘤的种子”。因此,研究者们认为,确保基因组(与疾病相关的目标基因)被编辑的细胞在“被编辑前和被编辑后”都具有功能性的p53是至关重要的。
一些反思
针对这两项成果,也有科学家提出了非常明显的问题——如果被CRISPR成功编辑的细胞会埋下癌症的种子,那么,为什么之前没有相关的报道呢?为什么那么多被CRISPR编辑过的小鼠没有形成肿瘤呢?
对此,Haapaniemi博士表示,新研究发现的这种效应(即被CRISPR成功编辑的细胞是因为p53没有发挥作用)是在大规模实验中显示出来的。不过,在与其他科学家的交谈中,她发现,似乎也有别的团队注意到了p53对基因编辑的影响,但他们并没有***提出这一问题。
至于为什么没有人报道经CRISPR编辑的小鼠患上癌症,Haapaniemi博士认为,其中一个原因可能是,实验室小鼠被杀死得较早,因而留给它们发展成癌症的时间过少。
新成果的发表除了引发热议,还对致力于开发CRISPR疗法的几家上市公司的股价带来了直接的影响。其中,CRISPR Therapeutics的CEO Sam Kulkarni在接受采访时表示:“这些研究结果‘似乎可信’。确保‘返还’给病人的、被编辑过的细胞不是癌变的确实是我们需要注意的事情。”
“CRISPR或能增加癌症风险”这一重要发现引发了人们对基于CRISPR的基因疗法的安全性的担忧,需要引起研究人员的广泛关注。