联 系 人:吉恩特客服
手 机:136-0866-9917(微信同号)
地 址:河南省洛阳市高新区火炬创业园
非酒精性脂肪性肝病(NAFLD)目前是一种日益增长的慢性流行病,并与心血管疾病(CVD)相关。然而,NAFLD如何影响CVD的发生和进展仍然不清楚。

2023年9月4日,中山大学凌文华及广州医科大学Xue Hongliang共同通讯在Journal of Hepatology(IF=26)在线发表题为“Hepatic steatosis aggravates atherosclerosis via small extracellular vesicle-mediated inhibition of cellular cholesterol efflux”的研究论文,该研究表明肝脂肪变性通过小细胞外囊泡介导的抑制细胞胆固醇外排加重动脉粥样硬化。来自脂肪变性肝细胞的sEVs通过抑制ABCA在动脉粥样硬化进展中的作用。此外,肝细胞特异性缺失Rab27a可显著改善ApoE-/-小鼠高脂高胆固醇(HFHC)诱导的AS进展。Rab27a是调节sEVs释放的关键GTPase。miRNA深度测序结果显示,脂肪变性肝细胞的sEVs中富集了miR-30a-3p。
miR-30a-3p直接靶向ABCA1 3'UTR抑制ABCA1表达和胆固醇外排。anagomiR-30a-3p治疗显著减轻HFHC喂养的ApoE-/-小鼠的动脉粥样硬化进展。此外,NAFLD患者血清sEVs降低了泡沫细胞中的胆固醇外排水平。sEV-miRNA-30a-3p相对含量与泡沫细胞胆固醇外排水平变化呈负相关。总之,脂肪变性肝细胞衍生的sEVs通过miR-30a-3p/ABCA1轴促进泡沫细胞形成和动脉粥样硬化。靶向和减少肝脏脂肪变性sEVs分泌或miR-30a-3p可能是减缓NAFLD驱动的AS进展的潜在治疗方法。
久坐不动的生活方式和高热量食物的过度消费导致非酒精性脂肪性肝病(NAFLD)成为全球***普遍的肝病。有证据表明,NAFLD可影响包括心血管疾病(CVDs)在内的主要肝外代谢。肝脂肪变性与CVD和CVD相关事件的风险密切相关。动脉粥样硬化(AS)的发展和进展是心血管疾病的病理生理基础。然而,肝脂肪变性加速AS发展和进展的确切机制尚不清楚。
细胞外囊泡(Extracellular vesicles,简称EVs)是源自供体细胞的膜状颗粒,可将其载货蛋白或miRNA运送到受体细胞,在代谢信号的器官间传递中发挥重要作用。作为细胞内通信的载体,EVs载货量可随着供体细胞受到的刺激而改变。小EVs通常指直径小于200 nm的EVs,其中包括外泌体和微泡。脂质超载后,肝细胞来源的sEVs在释放sEVs的数量和组成方面显示出巨大的变化。来自脂肪变性肝细胞的小EVs可加重肝脏炎症和NAFLD进展。然而,来自脂肪性肝细胞的sEVs是否会影响肝外代谢状况,尤其是AS,以及来自肝脂肪变性的细胞特异性信号如何调节AS进展仍然是悬而未决的问题。
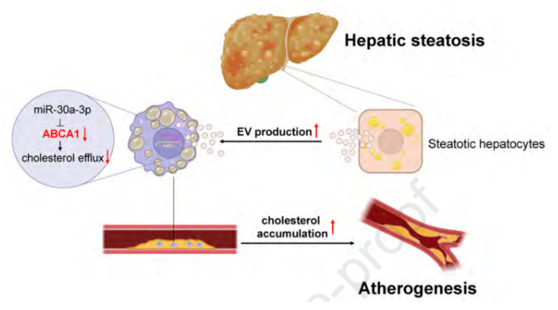
机理模式图(图源自Journal of Hepatology)
动脉内膜中富含胆固醇的泡沫细胞是动脉粥样硬化进展的标志。动脉粥样硬化中泡沫细胞的主要细胞类型是巨噬细胞,巨噬细胞可以通过逆向胆固醇转运降低过量的细胞胆固醇水平 (RCT)。RCT的***步是HDL通过ABCA1、ABCG1或SR-BI转运蛋白促进巨噬细胞的胆固醇外排,然后HDL-胆固醇被转运到肝脏排泄。越来越多的证据表明,巨噬细胞的RCT损伤会加剧AS的进展。
DNA提取磁珠可以有效的从标本中提取基因组DNA、病毒DNA或游离DNA,采用化学合成的方法将四氧化三铁进行特殊的处理,使其粒径达到均一化分散,再通过特殊的材料进行官能基团(如硅羟基、羧基)的包覆。包覆官能基团后,磁珠具备了核酸吸附能力,配合核酸提取仪,可以自动化的提取DNA和RNA。